
 NaClO2溶液中可能存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒.用稀H2SO4或NaOH溶液调整溶液pH,经测定,25℃时各组分含量随pH的变化情况如图所示(Cl-没有画出).则该温度下,下列分析不正确的是( )
NaClO2溶液中可能存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒.用稀H2SO4或NaOH溶液调整溶液pH,经测定,25℃时各组分含量随pH的变化情况如图所示(Cl-没有画出).则该温度下,下列分析不正确的是( )| A. | NaClO2溶液呈碱性 | |
| B. | HClO2的电离平衡常数Ka=1.0×10-6 | |
| C. | pH=8的NaClO2溶液中:c(Na+)+c(H+)=c(ClO2-)+c(OH-) | |
| D. | pH=5时含氯元素的微粒浓度大小关系:c(HClO2)>c(ClO2-)>c(Cl-)>c(ClO2) |
分析 A、NaClO2溶液中存在HClO2,说明ClO2-能够水解;
B、HClO2的电离平衡常数K=$\frac{[{H}^{+}]•[Cl{{O}_{2}}^{-}]}{[HCl{O}_{2}]}$结合图示数据来计算;
C、据电荷守恒分析;
D、根据图象无法确定c(ClO2-)与c(Cl-)的相对大小.
解答 解:A、NaClO2是强碱弱酸盐,水解显碱性,故A正确;
B、HClO2的电离平衡常数K=$\frac{[{H}^{+}]•[Cl{{O}_{2}}^{-}]}{[HCl{O}_{2}]}$,观察图象可以看出,当pH=6时,c(ClO2-)=c(HClO2),因此HClO2的电离平衡常数的数值Ka=10-6,故B正确;
C、NaClO2溶液中只有四种离子,据电荷守恒c(Na+)+c(H+)=c(ClO2-)+c(OH-),故C正确;
D、由图象可知,含氯元素的微粒浓度大小关系为c(HClO2)>c(ClO2-)>c(ClO2),但是根据图象无法确定c(ClO2-)与c(Cl-)的相对大小,故D错误;
故选D.
点评 本题考查了酸碱混合的定性判断,题目难度稍大,正确分析、理解题中信息及图象数据是解答本题关键,注意明确溶液酸碱性与溶液pH的关系.


科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ②④⑤⑦ | C. | ③④⑥⑦ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=10的NaOH溶液和pH=4的醋溶液等体积混合后溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$<1 | |
| B. | 向Ba(OH)2和氨水的混合溶液中滴加盐酸时$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$减小 | |
| C. | Na2CO3溶液中通入CO2,$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$保持不变 | |
| D. | HClO溶液稀释为原来体积的100倍,$\frac{c(Cl{O}^{-})}{c(HClO)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能够降低化学反应的反应热(△H) | |
| B. | 点燃爆竹后,硫燃烧生成SO3 | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用10mL量筒量取5.00mL KMnO4溶夜 | |
| B. | 用瓷坩埚灼烧氢氧化钠、碳酸钠 | |
| C. | 蒸馏时蒸馏烧瓶中液体的体积不能超过其容积的$\frac{2}{3}$,液体也不能蒸干 | |
| D. | 把粉未状氢氧化钠固体直接放在天平的托盘中称量,其质量为7.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
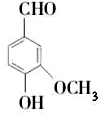 香草醛,又名香兰素,学名3-甲氧基-4-羟基苯甲醛.是食品工业和药品工业中重要的化学原料其结构简式如图所示,下列有关香草醛性质的说法中不正确的是( )
香草醛,又名香兰素,学名3-甲氧基-4-羟基苯甲醛.是食品工业和药品工业中重要的化学原料其结构简式如图所示,下列有关香草醛性质的说法中不正确的是( )| A. | 香草醛可以发生银镜反应 | |
| B. | 香草醛遇FeCl3溶液可以变紫色 | |
| C. | 香草醛在一定条件下可以与H2反应 | |
| D. | 香草醛既可以与NaOH溶液反应,也可以与NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应速率v正(X)=$\frac{m}{n}$ v逆(Y) | B. | 降低温度,c$\frac{c(Y)}{c(Z)}$的值变小 | ||
| C. | 增加Y的物质的量,X的转化率增大 | D. | 加入X,反应的△H增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com