
| A. | CaF2难溶于水,其水溶液的导电性极弱 | |
| B. | CaF2的熔、沸点较高,硬度较大 | |
| C. | CaF2固体不导电,但在熔融状态下可以导电 | |
| D. | CaF2在有机溶剂(如苯)中的溶解度极小 |
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.24LCO2中含0.3NA原子 | |
| B. | 0.3molNH4NO3固体中含0.3NANH4+ | |
| C. | 5.6g铁粉完全反应一定失去0.3NA电子 | |
| D. | 25℃,0.1NAHCl气体溶于1L水,溶液pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过石油的裂解可以获得更多的汽油 | |
| B. | 蛋白质、纤维素、油脂、聚乙烯、淀粉都是高分子化合物 | |
| C. | 研制乙醇汽油(汽油中添加一定比例的乙醇)技术,可以降低机动车辆尾气中有害气体排放 | |
| D. | 石油、煤、天然气、植物油都属于化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
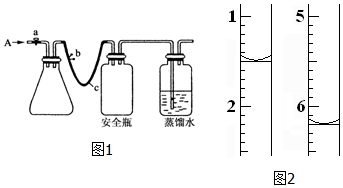
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,具有相同数目分子的气体必具有相同的体积 | |
| B. | 等质量的O2和H2的物质的量之比为16:1 | |
| C. | 不同的气体若体积不等,则它们所含的分子数一定不等 | |
| D. | 同温同体积下,两种气体的物质的量之比等于密度之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光照新制的氯水时,溶液的pH逐渐减小 | |
| B. | 棕红色的NO2加压后颜色先变深后变浅(已知:2NO2 (g)?N2O4 (g)) | |
| C. | 工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 | |
| D. | 煅烧粉碎的硫铁矿利于SO2的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
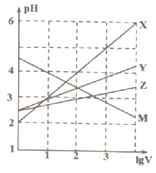 常温下取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3.且HA和HB的1L溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是( )
常温下取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3.且HA和HB的1L溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是( )| A. | X是HA,M是HB | |
| B. | 常温下pH:NaA溶液>NaB溶液 | |
| C. | 对于$\frac{c({R}^{-})}{c(HR)c(O{H}^{-})}$的值(R代表A或B),一定存在HA>HB | |
| D. | 若常温下浓度均为0.1mol/L的NaA和HA的混合溶液的pH>7,则c(A-)>c(HA) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com