
| A、2mol?L-1 |
| B、4mol?L-1 |
| C、6mol?L-1 |
| D、8mol?L-1 |
| n(NaOH) |
| V(HCl) |
| 5mol/L×0.16L |
| 0.1L |


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从溴水中提取溴可用酒精作为萃取剂 |
| B、检验碘化钾溶液可用淀粉 |
| C、分离碘和食盐可用加热的方法 |
| D、用加热的方法除去铜中混有的氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 光Br2 |
| NaOH、醇△ |
| 溴水 |
| NaOH、水 |
| O2、催化剂Cu |
| 一定条件 |
| 1,2-乙二醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沉淀溶解达到平衡时,溶液中各离子的浓度一定相等 |
| B、沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
| C、难溶电解质的溶解平衡是一种动态平衡,可以通过改变条件使平衡移动 |
| D、沉淀转化的实质就是沉淀溶解平衡的移动,一般说来,溶解度小的沉淀转化成溶解度大的沉淀更容易实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| A、混合物中含有0.5molFeS |
| B、混合物中含有0.1mol FeO |
| C、参加反应的HNO3为1mol |
| D、氧化产物Fe3+为0.15mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
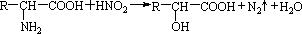
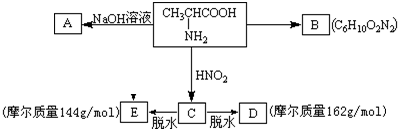
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g) | 74 | 0.0009 | 0.02 |
| A、已知MgCO3的Ksp=6.8×10-6(mol?L-1)2,则所有含固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.8×10-6 (mol?L-1)2 |
| B、将MgCl2与水混合,再对溶液蒸干、灼烧,最终所得固体产物为MgO |
| C、除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 |
| D、用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com