
已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色的溶液,其化学方程式是:PbSO4+2NH4Ac  Pb(Ac)2+(NH4)2SO4。当Pb(Ac)2(醋酸铅)溶液中通入H2S时,有黑色沉淀PbS和弱电解质HAc生成。表示这个反应的有关离子方程式正确的是( )
Pb(Ac)2+(NH4)2SO4。当Pb(Ac)2(醋酸铅)溶液中通入H2S时,有黑色沉淀PbS和弱电解质HAc生成。表示这个反应的有关离子方程式正确的是( )
A.Pb(Ac)2+H2S PbS↓+2HAc
PbS↓+2HAc
B.Pb2++H2S PbS↓+2H+
PbS↓+2H+
C.Pb2++2Ac-+H2S PbS↓+2HAc
PbS↓+2HAc
D.Pb2++2Ac-+2H++S2— PbS↓+2HAc
PbS↓+2HAc
科目:高中化学 来源:2016-2017学年贵州省高一上期中化学卷(解析版) 题型:选择题
下列说法正确的是 ( )
A.硫酸、纯碱、碳酸氢钠和生石灰分别属于酸、碱、盐和氧化物
B.用丁达尔效应区别FeCl3溶液和Fe(OH)3胶体
C.生石灰与水混合的过程只发生物理变化
D.H2O、CH3COOH、Cu(NH3)4SO4均含有氧,都是氧化物
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长株潭岳益五市十校高三12月联考化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀
B.铝热剂、福尔马林、水玻璃、漂白粉均为混合物
C.一定条件下, 1mol苯甲醛最多能与3molH2反应
D.乙醇、乙酸均能与NaOH稀溶液反应,因为分子中均含有官能团“﹣OH”
查看答案和解析>>
科目:高中化学 来源:2017届安徽省培优联盟高三冬季联赛化学试卷(解析版) 题型:选择题
下图所示的锌溴液流电池是一种新型电化学储能装置,以溴化锌水溶液为电解液,电解液在电解质储罐和电池间不断循环.下列说法不正确的是( )
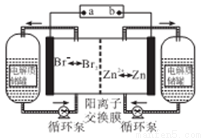
A.放电时,负极的电极反应式为Zn =Zn2++2e-
B.阳离子交换膜可阻止Br2与Zn直接发生反应
C.充电时,Zn2+往离子交换膜左侧区域迁移
D.放电时左侧电解质储罐中的离子总浓度增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省分校高一上期中化学卷(解析版) 题型:实验题
某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42ˉ。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),设计了如图所示的流程图:
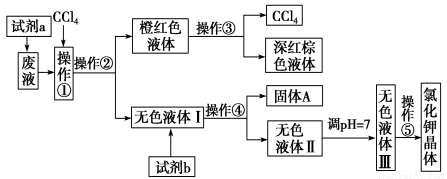
可供试剂a、试剂b(试剂b代表一组试剂)选择的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液、酸性KMnO4溶液、稀盐酸。
请根据流程图,回答相关问题:
(1) 操作①②③④⑤的名称是_____________
①_______②________③________④________⑤________
(2) 除去无色液体Ⅰ中的Ca2+、Mg2+、SO42ˉ, 选出试剂b所代表的试剂,按滴加顺序依次是________________(填化学式)。
选出试剂b所代表的试剂,按滴加顺序依次是________________(填化学式)。
(3)调节pH的目的是____________________,操作方法是_______________________。
(4)操作⑤中用到的瓷质仪器名称是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省分校高一上期中化学卷(解析版) 题型:选择题
淀粉溶液是一种胶体,并且淀粉遇到碘单质,可以出现明显的蓝色特征。现将淀粉和稀Na2SO4溶液混合,装在半透膜中,浸泡在盛蒸馏水的烧杯内,过一段时间后,取烧杯中液体进行实验,能证明半透膜完好无损的是
A.加入BaCl2溶液产生白色沉淀 B.加入碘水不变蓝
C.加入BaCl2 溶液没有白色沉淀产生 D.加入碘水变蓝
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省分校高一上期中化学卷(解析版) 题型:选择题
下列有关气体体积的叙述中,正确的是
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,如体积不同,则它们所含的分子数也不同
D.气体摩尔体积是指1mol任何气体所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省分校高二上期中化学卷(解析版) 题型:选择题
下列反应中前者属于取代反应,后者属于加成反应的是( )
A.甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色
B.乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷
C.苯与浓硝酸和浓硫酸的混合液加热反应;乙烯与水在一定条件下生成乙醇的反应
D.在苯中滴入溴水,溴水层变无色;乙烯生成聚乙烯的反应
查看答案和解析>>
科目:高中化学 来源:2017四川省自贡市高三第一次诊断考试化学试卷(解析版) 题型:填空题
甲醇是重要的绿色能源之一,目前科学家用水煤气(CO+H2)合成甲醇,其反应为:
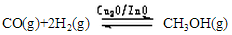 △H=-128.1kJ·mol-1,回答下列问题:
△H=-128.1kJ·mol-1,回答下列问题:
(1)该反应是可逆反应,为使化学反应速率和CO的转化率都同时提高的措施有_____________(写两条)。
(2)恒温恒容条件能说明该可逆反应达平衡的是______________;
A.2v正(H2)=v逆(CH3OH)
B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合气体的密度不变
D.混合气体的平均相对分子质量不变
(3)若上述可逆反应在恒温恒容的密闭容器进行,起始时间向该容器中冲入1molCO(g)和2molH2(g)。实验测得H2的平衡转化率随温度(T)、压强(P)的变化如图所示。

该反应的△S____________0,图中的T1___________T2(填“<”“>”或“=”)
②T1下到达平衡状态A时,容器的体积为2L,此时该反应的平衡常数为_____________,若达到平衡状态B时,则容器的体积V(B)=________L。
(4)已知:H2(g)燃烧热△H=-285.8kJ·mol-1、和CO(g)燃烧热△H=-283.0kJ·mol-1,则CH3OH(g)燃烧热的热化学方程式是为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com