
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中位置,用化学用语回答下列问题:
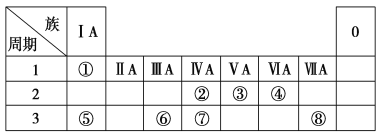
(1)④、⑤、⑥的原子半径由大到小的顺序是________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_____________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种具有漂白性的化合物的电子式:________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.KMnO4 c.Na2SO3 d.Fe2(SO4)3
(5)用电子式表示①与③组成的最简单的化合物的形成过程:_________________ 。
【答案】Na>Al>O HNO3>H2CO3>H2SiO3 ![]() ad
ad 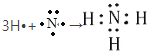
【解析】
①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl。
⑴原子半径从左到右依次减小,从上到下依次递减,得到半径大小关系。
⑵非金属性越强,其最高价含氧酸的酸性越强,得到酸性强弱顺序。
⑶具有漂白性的化合物为次氯酸钠,再书写电子式。
⑷由表中两种元素的原子按1∶1组成的常见液态化合物为过氧化氢,一般是二氧化锰和铁离子起催化作用。
⑸氨气是三个氢原子和一个氮原子形成,再书写电子形成过程。
⑴原子半径从左到右依次减小,从上到下依次递减,因此④、⑤、⑥的原子半径由大到小的顺序是Na>Al>O,故答案为:Na>Al>O。
⑵非金属性越强,其最高价含氧酸的酸性越强,因此②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3。
⑶①H、④O、⑤Na、⑧Cl中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种具有漂白性的化合物为次氯酸钠,其电子式:![]() ,故答案为:
,故答案为:![]() 。
。
⑷由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,则为过氧化氢,一般二氧化锰和铁离子其催化作用,故答案为:ad。
⑸氨气是三个氢原子和一个氮原子形成,用电子式表示①与③组成的最简单的化合物的形成过程: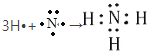 ,故答案为:
,故答案为: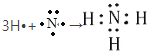 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(一)、 一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:

(1)降低温度,SO2的转化率_________,化学反应速度_________。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是_________。
(3)反应进行至20 min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
(二) 在一个固定体积的密闭容器中,充入 2 mol A 和1 mol B,发生如下反应:2 A(g) + B(g)![]() 3C(g) + D(s), 反应达到平衡时 C的浓度为1.2 mol/L。
3C(g) + D(s), 反应达到平衡时 C的浓度为1.2 mol/L。
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为_____反应(填“吸热”或“放热”)反应。
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是____________(用序号填空)
① 4 mol A + 2 mol B ② 3 mol C + 1 mol D + 1 mol B
③ 3 mol C + 2 mol D ④ 1.6 mol A + 0.8 mol B + 0.6 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5mol/L Li2SO4水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是( )
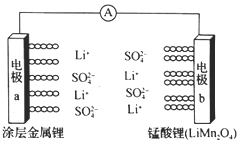
A.该电池放电时,溶液中的SO42-向电极b移动
B.该电池负极的电极反应式为:2Li+2H2O=2LiOH+H2↑
C.电池充电时,阳极的电极反应式为:Li2Mn2O4-e-=LiMn2O4+Li+
D.电池充电时,外加直流电源的正极与电极a相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池如图所示,电池总反应为:
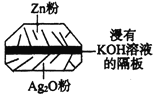
Zn + Ag2O + H2O = 2Ag + Zn(OH)2。下列叙述中正确的是( )
A.在使用过程中,电解质KOH不断被消耗
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.正极反应式为:Ag2O+H2O+2e- = 2Ag+2OH-
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法制备碳酸氢钠的原理为NH3+H2O+CO2 +NaCl=NH4Cl+NaHCO3↓,某化学小组用如图装置在实验室中模拟该制备过程,下列说法不正确的是
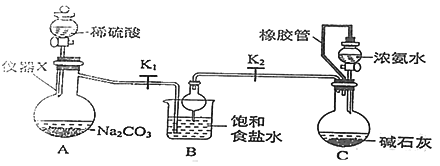
A. 装置A中仪器X的名称为蒸馏烧瓶
B. 装置B中球形干燥管的作用是防止倒吸
C. 装置C中橡胶管的作用是平衡压强,使溶液顺利滴下
D. 实验开始后,应先打开K1一段时间,然后再打开K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
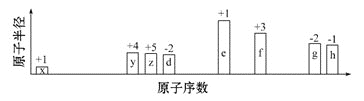
根据判断出的元素回答问题:
(1)f在周期表中的位置是____________________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):________>________;比较g、h的最高价氧化物对应水化物的酸性强弱________>________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:__________________。
(4)写出e的单质在足量d2中燃烧后的产物与y的高价氧化物反应的化学方程式:______。
(5)写出由x、y、z、d四种元素构成的离子化合物的化学式(写一种)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应Na2Sx与 NaClO的物质的量之比为1∶16,则x的值为_________。
(2)实验室制取氯气,将多余的氯气用100 mL 1.7mol/LNaOH溶液完全吸收。对吸收后溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化),ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
①被还原的氯气的物质的量为 _______________mol。
②若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体A在空气中点燃,火焰呈黄色,并生成淡黄色固体B;将A在空气中露置,最后变成白色固体C。将A、B投入水中都生成D;B、C、D在一定条件下均能与二氧化碳反应。
(1)A是___;B是___;C是___;D是___。(填化学符号)
(2)完成下列方程式:
B与H2O反应的化学方程___。
向C的稀溶液中通入CO2的离子方程式____。
A与H2O反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近来查明二氧化三碳(![]() )是金星大气层的一个组成部分,下列关于
)是金星大气层的一个组成部分,下列关于![]() 说法不正确的是 ( )
说法不正确的是 ( )
A. 结构式可能为:![]() B.
B. ![]() 、CO、
、CO、![]() 都是碳的氧化物
都是碳的氧化物
C. ![]() 不属于酸性氧化物D.
不属于酸性氧化物D. ![]() 、CO都可以燃烧生成
、CO都可以燃烧生成![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com