
【题目】已知Cl-、Br-、Fe2+、I-的还原性依次增强。现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如右图所示,请回答:

(1)a、c线分别代表溶液中__________、________(填离子符号,下同)的变化情况;
(2)原溶液中FeI2的物质的量为__________;
(3)原溶液中Fe2+与Br-的物质的量之比为____________;
(4)当通入2mol Cl2时,溶液中离子反应为______________________。
【答案】(1)I- Fe3+(2)1mol (3)2∶3
(4)2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
【解析】
试题分析:(1)根据还原性强弱顺序可知通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,a曲线代表碘离子;通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,b曲线表示亚铁离子,铁离子的物质的量从0增加到4mol,c曲线表示铁离子;在通入氯气的量为3~6mol的过程中溴离子从6mol降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,d曲线表示溴离子;
(2)根据以上分析可知碘化亚铁的物质的量是1mol;
(3)原溶液中亚铁离子和溴离子的物质的量之比是4mol:6mol=2:3;
(4)当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-。


科目:高中化学 来源: 题型:
【题目】下列有关实验的叙述正确的是( )

A.闻未知液体气味时,应该将试剂瓶口距离口鼻远一些,用手轻轻扇动
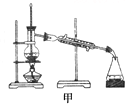
B.将碘单质从碘的CCl4溶液中分离出来可用如图甲所示实验装置
C.用容量瓶配制好一定浓度的某溶液后,塞紧瓶塞并在容量瓶上贴上标签
D.配制500 mL 0.4 mol·L-1NaCl溶液,必要的仪器如图乙所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色透明的溶液中:K+、Cu2+、NO![]() 、Cl-
、Cl-
B.0.1 mol·L-1CaCl2溶液中:Mg2+、NH![]() 、CO
、CO![]() 、SO
、SO![]()
C.pH=12的溶液:Na+、K+、SiO![]() 、Cl-
、Cl-
D.使甲基橙变红的溶液中:Na+、Fe2+、NO![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A、υ(A)=0.5mol/(L·min) B、υ(B)=1.2mol/(L·s)
C、υ(C)=0.1mol/(L·s) D、υ(D)=0.4mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述不正确的是
A.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈紫色
B.在pH=3的溶液中,Na+、Cl-、Fe2+、ClO-不能大量共存
C.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)=c(NH4+)>c(H+)=c(OHˉ)
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2和X气体分别通入BaC12溶液中,未见沉淀生成,若同时通入,有沉淀生成,则X气体不可能是( )
A. CO2 B. NH3 C. Cl2 D. H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.Na2CO3水解:CO![]() +H2O == H2CO3+2OH-
+H2O == H2CO3+2OH-
B.NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C.Cu与稀HNO3反应:Cu+4H++2NO![]() =Cu2++2NO↑+2H2O
=Cu2++2NO↑+2H2O
D.醋酸除水垢:CO![]() +2CH3COOH===2CH3COO-+CO2↑+H2O
+2CH3COOH===2CH3COO-+CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com