
| A. | ②③ | B. | ①③ | C. | ①④ | D. | ③④ |
分析 用标准浓度的NaOH溶液来滴定未知浓度的盐酸,发生HCl+NaOH=NaCl+H2O,由c酸=$\frac{{c}_{碱}{V}_{碱}}{{V}_{酸}}$可知,若消耗的NaOH偏多,测定盐酸的浓度偏大,以此来解答.
解答 解:①碱式滴定管用蒸馏水洗净后未用标准溶液润洗,则消耗的NaOH偏多,由c酸=$\frac{{c}_{碱}{V}_{碱}}{{V}_{酸}}$可知,测定盐酸的浓度偏大,故选;
②锥形瓶中盛有少量蒸馏水,就加待测液,对物质的量无影响,浓度不变,故不选;
③滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失,则消耗的NaOH偏多,由c酸=$\frac{{c}_{碱}{V}_{碱}}{{V}_{酸}}$可知,测定盐酸的浓度偏大,故选;
④滴定后俯视滴定管读数读取NaOH溶液的体积,读出消耗的NaOH偏少,由c酸=$\frac{{c}_{碱}{V}_{碱}}{{V}_{酸}}$可知,测定盐酸的浓度偏小,故不选;
故选B.
点评 本题考查中和滴定,为高频考点,把握滴定原理、仪器的使用及误差分析为解答的关键,侧重分析与实验能力的考查,注意滴定管的小刻度在上方,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室可用排饱和食盐水的方法收集氯气 | |
| B. | 加催化剂,使N2和H2在一定条件下转化为NH3 | |
| C. | 打开汽水瓶,看到有大量的气泡逸出 | |
| D. | Fe(SCN)3溶液中加入6mol/LNaOH溶液后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )| A. | 向a试管中先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时试管b中饱和Na2CO3溶液的作用是吸收乙醇、中和乙酸及降低乙酸乙酯的溶解度便于分层 | |
| D. | 长玻璃导管只有导气的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
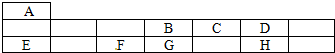
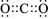 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
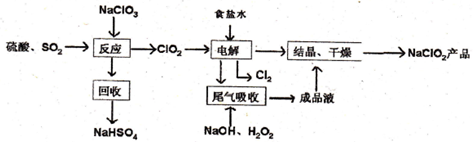
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤③②⑥ | B. | ④①③⑤②⑥ | C. | ⑤④③①②⑥ | D. | ③④⑤①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤①③⑥ | B. | ⑤④②①③⑥ | C. | ⑤④②③①⑥ | D. | ②④⑤③①⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com