
 已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.请回答下列问题:
已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.请回答下列问题:分析 (1)依据燃烧热的概念和热化学方程式含义,结合盖斯定律计算得到由S(s)生成3molSO3(g)的△H;
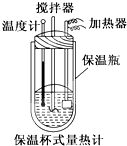
(2)根据化学反应热的计算公式Q=-cm△T来计算;
(3)根据中和热的测定中能够导致放出的热量偏低的因素进行解答.
解答 解:(1)单质硫的燃烧热为296kJ•mol-1,热化学方程式为:①S(s)+O2(g)=SO2(g)△H1=-296 KJ•mol-1,已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.热化学方程式为②SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H2=-99 KJ•mol-1 ;依据盖斯定律,②+①得到:③S(s)+$\frac{3}{2}$O2(g)=SO3(g)△H=(△H1+△H2)KJ/mol═-395KJ•mol-1;计算由S(s)生成3molSO3(g)③×3得到:3S(s)+$\frac{9}{2}$O2(g)=3SO3(g)△H=3(△H1+△H2)=-1185 KJ•mol-1,
故答案为:-1185 KJ•mol-1;
(2)将100mL 0.50mol/L的CH3COOH溶液与100mL 0.55mol/L NaOH溶液混合,完全反应生成0.05mol水放出的热量为:Q=cm△T=[150.5J/K+4.184J/(g•K)×200mL×]×(300.7-298)K=2665.71kJ,则生成1mol水放出的热量为:2665.71kJ×$\frac{1mol}{0.05mol}$=53314.2J≈5.33×104J=53.3 kJ,
所以CH3COOH的中和热△H=-53.3 kJ/mol,
故答案为:-53.3kJ/mol;
(3)CH3COOH的中和热的文献值为-56.1kJ/mol,实际上测定数值偏低,可能原因有:①量热计的保温瓶效果不好,②酸碱溶液混合不迅速,③温度计不够精确等,
故答案为:①量热计的保温瓶效果不好,②酸碱溶液混合不迅速(③温度计不够精确等).
点评 本题考查了反应热的计算、中和热的测定,题目难度中等,注意掌握盖斯定律的含义及利用盖斯定律计算反应热的方法,明确测定中和热的原理、操作方法.


科目:高中化学 来源: 题型:选择题
 1,2,3-三苯基环丙烷的3个苯基可以分布在环丙环平面的上下,因此有如下2个异构体.[Φ是苯基,环用键线表示,C、H原子都未画出]据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的异构体数是( )
1,2,3-三苯基环丙烷的3个苯基可以分布在环丙环平面的上下,因此有如下2个异构体.[Φ是苯基,环用键线表示,C、H原子都未画出]据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的异构体数是( )| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
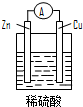
| A. | 铜片是负极 | B. | 铜片表面反应为:Cu-2e- Cu2+ | ||
| C. | 电流从锌片经导线流向铜片 | D. | 氢离子在铜片表面被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 不慎把苯酚沾到了皮肤上,应立即用酒精洗涤,再用水冲洗 | |
| B. | 配制银氨溶液时,将稀氨水滴加到硝酸银溶液中,至产生的沉淀溶解为止 | |
| C. | 淀粉水解后,直接滴加新制氢氧化铜悬浊液并加热检验水解产物中的葡萄糖 | |
| D. | 在苯和液溴的混合物中加少量铁粉即可得到溴苯 | |
| E. | 向溴乙烷跟烧碱反应后的混合液中滴加硝酸银溶液,可以检验水解生成的溴离子 | |
| F. | 实验室进行石油的蒸馏、乙酸乙酯的水解、中和反应反应热的测定实验时均需要使用温度计 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
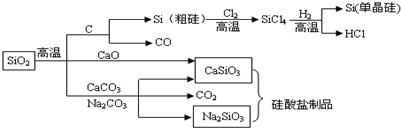
| A. | 图中所有的反应中,属于氧化还原反应的有3个 | |
| B. | 用硫酸可以除去石英砂(主要成分是SiO2)中少量的碳酸钙 | |
| C. | 工业制水泥、工业制玻璃、燃煤固硫等都用到原料石灰石 | |
| D. | 纯净的二氧化硅和单晶硅都是信息产业的重要基础原料,高纯度二氧化硅的广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动 | |
| B. | 金属晶体的熔点和沸点都很高 | |
| C. | 金属元素和非金属元素形成的化合物一定是离子化合物 | |
| D. | 离子化合物中一定含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应的化学平衡常数K | B. | 0.1mol/LCH3COONa溶液的PH | ||
| C. | 水的离子积常数Kw | D. | 弱电解质的电离程度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com