
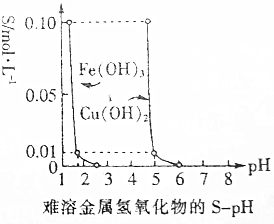
 25℃时,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )
25℃时,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )| A. | pH为5时,可除去CuCl2溶液中的少量Fe3+ | |
| B. | 温度升高时Fe(OH)3溶解速度加快 | |
| C. | 25℃下Ksp[Cu(OH)2]=1.0×10-20 | |
| D. | Fe(OH)3(s)的溶解度随pH增大而减小 |
分析 A.pH=5时大量铜离子能够与氢氧根离子反应生成了氢氧化铜沉淀;
B.温度升高,溶解反应速率会增大;
C.根据25℃时铜离子为0.01mol/L、pH=5计算出Ksp[Cu(OH)2];
D.氢氧化铁在溶液中存在溶解平衡,氢氧根离子浓度增大,则溶解平衡向着逆向移动,导致氢氧化铁的溶解度减小.
解答 解:A.根据图示可知,在pH=5时铜离子会与氢氧根离子生成沉淀,若除去CuCl2溶液中的少量Fe3+,应该使溶液的pH在3~4左右,故A错误;
B.氢氧化铁在溶液中存在溶解平衡,升高温度后,Fe(OH)3溶解速度会加快,故B正确;
C.由图示可知,pH=5时,铜离子浓度为0.01mol/L,此时氢氧根离子浓度为10-9mol/L,则Ksp[Cu(OH)2]=0.01×(10-9)2=1×10-20,故C正确;
D.Fe(OH)3(s)在溶液中存在溶解平衡,当溶液pH增大时,溶液中氢氧根离子浓度增大,则溶解平衡向着逆向移动,导致氢氧化铁的溶解减小,故D正确;
故选A.
点评 本题考查了难溶物的溶解平衡、溶度积的表达式及计算、物质的分离与提纯,题目难度中等,注意掌握难溶物的溶解平衡及其影响因素,明确溶度积的概念及计算方法.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 用酸性KMnO4溶液将Fe2+氧化成Fe3+,再转化为Fe(OH)3沉淀除去 | |
| B. | 用ZnO调节浸出液的酸碱性,可使某些离子形成氢氧化物沉淀 | |
| C. | 在实际生产过程中,加入Ag2SO4可除去Cl-,是利用了沉淀转化的原理 | |
| D. | 也可以用ZnCO3代替ZnO调节溶液的酸碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用电泳现象区别溶液和胶体 | |
| B. | 用渗析的方法除去胶体中的离子或分子,以净化胶体 | |
| C. | 用滤纸过滤除去溶液中的胶体粒子 | |
| D. | 向新制Fe(OH)3胶体中加入足量AgNO3溶液,以除去胶体中的Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )
实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )| A. | 该硫酸的物质的量浓度为9.2mol•L-1 | |
| B. | 1molAl与足量的该硫酸反应产生3g氢气 | |
| C. | 这种硫酸在常温下不能使铁钝化 | |
| D. | 配制80mL2.3mol•L-1的稀硫酸需量取该硫酸12.5 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | X | Y | Z | W |
| 原子半径(nm) | 0.077 | 0.075 | 0.102 | 0.099 |
| 最高正价或最低负价 | +4 | +5 | -2 | -1 |
| A. | X、Y、Z、W四种元素的单质均为分子晶体 | |
| B. | X、Y、Z、W四种元素的电负性:Y>X>W>Z | |
| C. | X与Z形成XZ2,其空间构型为直线型 | |
| D. | Y的氢化物与W的氢化物相互反应的产物只含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①② | C. | ①④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CrO42-和S2-在酸性溶液中可大量共存 | |
| B. | 实验②说明氧化性:Cr2O72->SO42- | |
| C. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 | |
| D. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com