
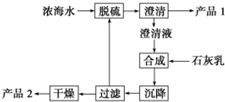
 海水淡化及海水资源的提取利用是当今化工行业重要课题.
海水淡化及海水资源的提取利用是当今化工行业重要课题.| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
分析 工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,用Ca2+沉淀SO42-生成CaSO4沉淀,离子方程式为:Ca2++SO42-=CaSO4↓,采用过滤的方法得到产品1为CaSO4,滤液中加入石灰乳,发生反应为Mg2++2OH-=Mg(OH)2↓,合成中应得到Mg(OH)2沉淀,过滤、干燥的产品2为Mg(OH)2,
(1)海水淡化海水就是将海水中的可溶性杂质除去的过程,可根据淡化原理进行分析解答;
(2)反应Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3中,Br元素化合价分别由0价变化为-1价、+5价,结合化合价的变化计算;
(3)工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁,计算1L溶液中Mg2+的质量,根据Mg2+~Mg(OH)2计算氢氧化镁的质量;
(4)电解熔融氯化镁得到Mg与氯气;电解时,若有少量水存在,Mg与水反应生成氢氧化镁与氢气,会造成产品镁的消耗.
解答 解:(1)①利用电渗析法可使相应的离子通过半透膜以达到硬水软化的效果,故①正确,
②蒸馏法是把水从水的混合物中分离出来,得到纯净的水,故②正确,
③通过离子交换树脂可以除去海水中的离子,从而达到淡化海水的目的,故③正确,
④过滤只能除去水中的不溶性杂质,不能淡化海水,故④错误,
故答案为:①②③;
(2)反应Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3中,Br元素化合价分别由0价变化为-1价、+5价,反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂(Br2)=2×5×n还原剂(Br2),故n氧化剂(Br2):n还原剂(Br2)=5:1,故吸收1mol Br2时,转移的电子数为1mol×2×$\frac{1}{1+5}$×5=$\frac{5}{3}$mol,
故答案为:$\frac{5}{3}$;
(3)①工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,用Ca2+沉淀SO42-生成CaSO4沉淀,离子方程式为:Ca2++SO42-=CaSO4↓,
故答案为:Ca2++SO42-═CaSO4↓:
②采用过滤的方法得到产品1为CaSO4,滤液中加入石灰乳,发生反应为Mg2++2OH-=Mg(OH)2↓,合成中应得到Mg(OH)2沉淀,过滤、干燥的产品2为Mg(OH)2,
溶液中m(Mg2+)=1L×28.8g/L=28.8g,
Mg2+~Mg(OH)2
24g 58g
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×$\frac{58g}{24g}$=69.6g,
故答案为:Mg(OH)2;69.6;
(4)电解熔融氯化镁得到Mg与氯气,电解反应方程式为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;电解时,若有少量水存在,Mg与水反应生成氢氧化镁与氢气,会造成产品镁的消耗,反应方程式为:Mg+2H2O$\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑,
故答案为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;Mg+2H2O$\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.
点评 本题考查了物质性质的分析应用,主要是氧化还原反应电子转移的计算,化学方程式计算,混合物成分的纯度计算应用,掌握物质性质和计算方法是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| B. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| C. | Y的气态简单氢化物的热稳定性比W的强 | |
| D. | X的最高价氧化物对应的水化物的酸性比W的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 若为电解饱和食盐水的装置,则a,b上均产生气体 | |
| B. | 若为工业冶炼铝的装置,则用熔融氯化铝作电解液 | |
| C. | 若为工业制钠的装置,则钠在a上生成 | |
| D. | 若利用该装置回收氯化铜溶液中的铜,则a不能是铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麻的主要成分表示为(C6H12O6)n | |
| B. | 丝的主要成分是蛋白质 | |
| C. | 麻和丝生要成分均属于高分子化合物 | |
| D. | 麻和丝可以通过灼烧进行区分 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
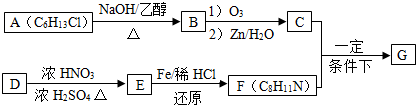
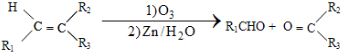
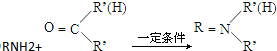
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$  +H2O;
+H2O; ;
;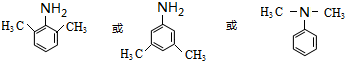 ,(写出其中的一种的结构简式).
,(写出其中的一种的结构简式).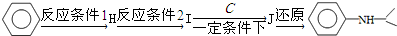
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
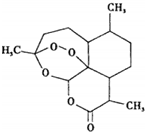 2015年诺贝尔生理学或医学奖授予中国药学家屠呦呦以及爱尔兰科学家威廉•坎贝尔和日本科学家大村智,表彰他们在寄生虫疾病治疗研究方面取得的成就.屠呦呦先驱性地发现了青蒿素,开创了疟疾治疗新方法.图为青蒿素,关于该物质的下列说法正确的是( )
2015年诺贝尔生理学或医学奖授予中国药学家屠呦呦以及爱尔兰科学家威廉•坎贝尔和日本科学家大村智,表彰他们在寄生虫疾病治疗研究方面取得的成就.屠呦呦先驱性地发现了青蒿素,开创了疟疾治疗新方法.图为青蒿素,关于该物质的下列说法正确的是( )| A. | 青蒿素化学式为C15H20O5 | B. | 在光照条件下可能发生取代反应 | ||
| C. | 可以与氢气发生加成反应 | D. | 水浸青蒿对治疗疟疾有良好的疗效 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外电子数为86 | B. | 中子数为86 | C. | 质子数为136 | D. | 核电荷数为222 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com