
分析 反应中Mn元素的化合价降低,则R元素的化合价升高,0.2m olRxO42-离子参加反应时,共转移0.4mol电子,则0.2mol×2×(4-$\frac{6}{x}$)=0.4,结合电子、电荷守恒解答.
解答 解:(1)Mn元素的化合价降低,则R失去电子被氧化,对应氧化产物为RO2,故答案为:RO2;
(2)0.2m olRxO42-离子参加反应时,共转移0.4mol电子,则0.2mol×x×(4-$\frac{6}{x}$)=0.4,解得x=2,故答案为:2;
(3)由电子、电荷守恒可知,离子反应为5R2O42-+2MnO4-+16H+=10RO2+2Mn2++8H2O,故答案为:5、2、16、10、2、8.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意电子、电荷守恒的应用,题目难度不大.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
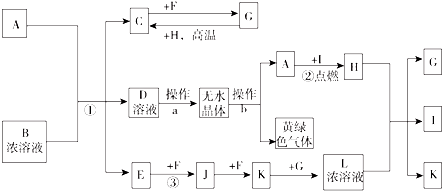
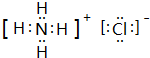 ;I分子的空间构型为直线形.
;I分子的空间构型为直线形.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
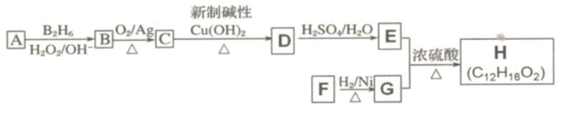
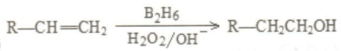
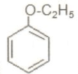 是同分异构体
是同分异构体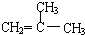 .
.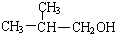 +O2$→_{△}^{Ag}$2
+O2$→_{△}^{Ag}$2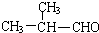 +2H2O.
+2H2O.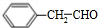 ;F分子中最多有15个原子共面.
;F分子中最多有15个原子共面.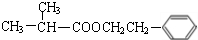 +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$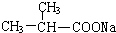 +
+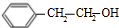 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:2 | C. | 2:1 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| B. | 向纯水中加入盐酸或金属钠都能使水的电离平衡逆向移动,水的离子积不变 | |
| C. | 向氯水中加入NaHCO3 (固体)可使溶液中c(HClO)增大 | |
| D. | 室温下,将浓度为0.1 mol•L-1 HF溶液加水稀释,其电离平衡常数和 c(H+)/c(HF)均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与氨水的反应:H++OH-═H2O | |
| B. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| C. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 氯气通入FeCl3溶液中:Cl2+Fe2+═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,它们物质的量必相等 | |
| B. | 在任何情况下,等质量的氮气和一氧化碳所含分子数必相等 | |
| C. | 1L一氧化碳气体的质量一定比1L氧气的质量小 | |
| D. | 等体积、等物质的量浓度的强酸中,所含的H+数目一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com