
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH________11(填“>”“=”或“<”)原因是______________________________________________(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH________NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为________;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),则混合后溶液呈________性,盐酸的体积________氨水的体积(填“>”“=”或“<”);
(5)NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42—。该溶液中c(H+)_________________________c(OH-)+c(SO42—)(填“>”“=”或“<”)。
(1)> 加水稀释使平衡CH3COO-+H2O CH3COOH+OH-右移 >
CH3COOH+OH-右移 >
(2)①=②>③ (3)碱 > 酸 < (4)中 < (5)=
【解析】 (1)首先写出CH3COO-+H2O??CH3COOH+OH-,加水稀释,假设平衡不移动,那么c(OH-)=10-1mol·L-1÷100=10-3mol·L-1,但平衡右移,c(OH-)应比10-3mol·L-1大,所以最终溶液中c(OH-)>10-3mol·L-1;加热促进了CH3COO-的水解,使c(OH-)增大;(2)依据NH4++H2O NH3·H2O+H+,因为①、②中的H+全部是水解生成的,且c(H+)相同,所以①=②;由NH4HSO4=NH4++H++SO42—可知③中的H+大部分是电离生成的,所以c(NH4HSO4)远远小于c(NH4Cl);(3)正好完全中和生成CH3COONa,CH3COO-水解,显碱性;混合后溶液中含有CH3COONa、CH3COOH,显酸性,溶液中存在CH3COONa=CH3COO-+Na+、CH3COO-+H2O
NH3·H2O+H+,因为①、②中的H+全部是水解生成的,且c(H+)相同,所以①=②;由NH4HSO4=NH4++H++SO42—可知③中的H+大部分是电离生成的,所以c(NH4HSO4)远远小于c(NH4Cl);(3)正好完全中和生成CH3COONa,CH3COO-水解,显碱性;混合后溶液中含有CH3COONa、CH3COOH,显酸性,溶液中存在CH3COONa=CH3COO-+Na+、CH3COO-+H2O CH3COOH+OH-、CH3COOH
CH3COOH+OH-、CH3COOH CH3COO-+H+、H2O
CH3COO-+H+、H2O OH-+H+,CH3COOH的电离程度大于CH3COO-的水解程度,所以电离生成的CH3COO-大于水解消耗的CH3COO-,即c(Na+)<c(CH3COO-);我们也可以用电荷守恒c(OH-)+c(CH3COO-)=c(H+)+c(Na+)求解,因为混合后溶液呈酸性,所以c(H+)>c(OH-),所以c(Na+)<c(CH3COO-);(4)由电荷守恒c(OH-)+c(Cl-)=c(H+)+c(NH4+)即可求解;(5)由电荷守恒c(OH-)+2c(SO42—)=c(H+)+c(Na+)、物料守恒c(SO42—)=c(Na+)两式组合即可求解。
OH-+H+,CH3COOH的电离程度大于CH3COO-的水解程度,所以电离生成的CH3COO-大于水解消耗的CH3COO-,即c(Na+)<c(CH3COO-);我们也可以用电荷守恒c(OH-)+c(CH3COO-)=c(H+)+c(Na+)求解,因为混合后溶液呈酸性,所以c(H+)>c(OH-),所以c(Na+)<c(CH3COO-);(4)由电荷守恒c(OH-)+c(Cl-)=c(H+)+c(NH4+)即可求解;(5)由电荷守恒c(OH-)+2c(SO42—)=c(H+)+c(Na+)、物料守恒c(SO42—)=c(Na+)两式组合即可求解。


科目:高中化学 来源:2014年高考化学考前题型专练 保温训练(二)(解析版) 题型:填空题
[物质结构与性质]已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。
试回答下列有关的问题:
(1)写出F元素的电子排布式:________________。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为__________。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子立体构型是________________。
(4)B、C、D、E的第一电离能由大到小的顺序是________(写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是________________(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
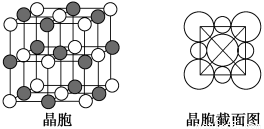
晶胞中距离一个B+最近的B+有________个。若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则E-的离子半径为________cm(用含NA与ρ的式子表达)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第9练非金属及其化合物练习卷(解析版) 题型:选择题
下列有关物质性质的应用正确的是( )
A.液氨汽化时要吸收大量的热,可用作制冷剂
B.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
C.生石灰能与水反应,可用来干燥氯气
D.氯化铝是一种电解质,可用于电解法制铝
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第7练电化学原理练习卷(解析版) 题型:填空题
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的开关K时,观察到电流计的指针发生了偏转。
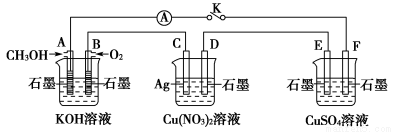
甲池 乙池 丙池
请回答下列问题:
(1)甲、乙、丙三池中为原电池的是________(填“甲池”“乙池”或“丙池”)。
(2)丙池中F电极为________(填“正极”“负极”“阴极”或“阳极”),该池的总反应式为__________________________________________________。
(3)当乙池中C电极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为________mL(标准状况)。
(4)一段时间后,断开开关K。下列物质能使丙池恢复到反应前浓度的是________(填选项字母)。
A.Cu B.CuO C.CuCO3 D.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第7练电化学原理练习卷(解析版) 题型:选择题
有关如图装置的叙述中,正确的是( )
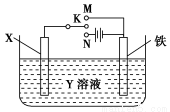
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为外接电源的阴极保护法
B.若X为碳棒,Y为饱和NaOH溶液,开关K置于N处,保持温度不变,则溶液的pH保持不变
C.若X为银棒,Y为硝酸银溶液,开关K置于N处,铁棒质量将增加,溶液中银离子浓度将减小
D.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铁电极移动
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第6练水溶液中的离子平衡练习卷(解析版) 题型:选择题
下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
A.0.1 mol·L-1 Na2CO3溶液中:c(Na+)=c(HCO3—)+c(H2CO3)+2c(CO32—)
B.常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7
C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第5练化学反应速率和化学平衡练习卷(解析版) 题型:填空题
(1)(浙江高考)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp),则反应CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=206.2 kJ·mol-1的Kp=________,随着温度的升高,该平衡常数________(填“增大”“减小”或“不变”)。
CO(g)+3H2(g) ΔH=206.2 kJ·mol-1的Kp=________,随着温度的升高,该平衡常数________(填“增大”“减小”或“不变”)。
(2)(天津高考)写出WO3(s)+3H2(g)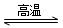 W(s)+3H2O(g)的化学平衡常数表达式为________。
W(s)+3H2O(g)的化学平衡常数表达式为________。
(3)(福建高考)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)??2C(g)+D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:________。
物质ABCD
起始投料/mol2120
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第4练物质结构与元素周期律练习卷(解析版) 题型:选择题
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
B.由水溶液的酸性:HCl>H2S,可推断元素的非金属性:Cl>S
C.硅、锗都位于金属与非金属的交界处,都可以作半导体材料
D.Cs和Ba分别位于第六周期ⅠA和ⅡA族,则碱性:CsOH>Ba(OH)2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第1练物质分类化学用语和常用计量练习卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol甲基(—CH3)中含有电子数为7NA
B.25 ℃时,pH=7的NH4Cl和NH3·H2O的混合溶液中,OH-数为10-7NA
C.4.6 g乙醇中含有共价键数目为0.8NA
D.两份均为2.7 g的铝样品分别与100 mL浓度均为2 mol·L-1的盐酸和氢氧化钠溶液充分反应,转移电子数均为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com