
分析 (1)根据热化学方程式和盖斯定律计算得到反应焓变;先写出负极的电极反应,然后根据正极的电极反应=总反应-正极的电极反应;
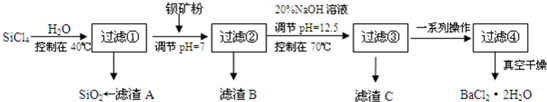
(2)流程分析可知四氯化硅控制温度40°C,加入水水解生成原硅酸和氯化氢,过滤得到盐酸溶液,加入钡矿粉主要成分为BaCO3,且含有铁、镁等离子,调节溶液pH=7,使BaCO3转化为BaCl2,同时使Fe3+完全沉淀,过滤得到滤渣为氢氧化铁,滤液加入氢氧化钠溶液调节溶液pH=12.5,控制70°C,得到氢氧化镁沉淀,过滤得到滤液为氯化钡溶液蒸发浓缩,冷却结晶,过滤洗涤得到氯化钡晶体;
①根据氯化硅水解生成原硅酸和氯化氢;
②根据难溶物的溶度积来计算;
③依据钡元素守恒,建立关系式:BaCO3 ~BaCl2•2H2O计算;
④根据外界条件浓度对平衡的影响分析.
解答 解:(1)①Mg(s)+$\frac{1}{2}$O2(g)=MgO(s)△H1=-601.8kJ/mol
②Mg(s)=Mg(g)△H2=+75kJ/mol
③Si(s)+O2(g)=SiO2(s)△H3=-859.4kJ/mol
依据盖斯定律②+③-①×2得到:2MgO(s)+Si(s)=SiO2(s)+2Mg(g)△H=+494.2kJ/mol;
电池总反应是:Mg+2NiOOH+2H2O═Mg(OH)2+2Ni(OH)2,负极的电极反应:Mg-2e-+2H2O═Mg(OH)2+2H+,正极的电极反应为:NiOOH+H2O+e-=Ni(OH)2+OH-;
故答案为:+494.2kJ/mol;NiOOH+H2O+e-=Ni(OH)2+OH-;
(2)流程分析可知四氯化硅控制温度40°C,加入水水解生成原硅酸和氯化氢,过滤得到盐酸溶液,加入钡矿粉主要成分为BaCO3,且含有铁、镁等离子,调节溶液pH=7,使BaCO3转化为BaCl2,同时使Fe3+完全沉淀,过滤得到滤渣为氢氧化铁,滤液加入氢氧化钠溶液调节溶液pH=12.5,控制70°C,得到氢氧化镁沉淀,过滤得到滤液为氯化钡溶液蒸发浓缩,冷却结晶,过滤洗涤得到氯化钡晶体;
①氯化硅水解生成原硅酸和氯化氢,水解方程式为:SiCl4+4H2O=H4SiO4↓+4HCl或SiCl4 +3H2O=H2SiO3↓+4HCl,
故答案为:SiCl4+4H2O=H4SiO4↓+4HCl或SiCl4 +3H2O=H2SiO3↓+4HCl;
②若加钡矿粉调节pH=3时,C(H+)=1.0×10-3mol/L,C(OH-)=$\frac{1×1{0}^{-14}}{1×1{0}^{-3}}$mol/L=1.0×10-11mol/L,根据氢氧化铁的溶度积Ksp[Fe(OH)3]=4.0×10-38,可知C(Fe3+)=$\frac{4.0×1{0}^{-38}}{(1.0×1{0}^{-11})^{3}}$mol/L=4.0×10-5mol/L,故答案为:4.0×10-5mol/L;
③5)10吨含78% BaCO3的钡矿粉理论上最多能生成BaCl2•2H2O质量xt,
BaCO3 ~BaCl2•2H2O
197 244
10t×78% x
$\frac{197}{10t×78%}=\frac{244}{x}$ 解得:x=9.66t,而实际上得到8.4吨BaCl2•2H2O,则产率为$\frac{8.4t}{9.66t}$×100%=86.9%,
故答案为:86.9%;
④Mg(OH)2(s)存在的溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH- (aq),NH4+与OH-结合生成难电离的NH3•H2O,使平衡向正反应方向移动,最终Mg(OH)2溶解,故答案为:Mg(OH)2(s)在溶液中存在的溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH- (aq),NH4+与OH-结合生成难电离的NH3•H2O,使平衡向正反应方向移动,最终Mg(OH)2溶解.
点评 本题考查盖斯定律与焓变的计算、新型电池电极反应式书写、沉淀溶解平衡的相关计算、关系式法计算.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用丁达尔现象区分溶液与胶体 | |
| B. | 化学变化能够实现一种原子变为另一种原子 | |
| C. | O3是由3个氧原子构成的化合物 | |
| D. | CuSO4•5H2O是一种混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol•L-1 | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(YX)/mol•L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
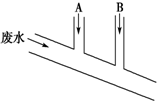 某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )
某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )| A. | 排出管A处发生的反应为SO32-+Cl2+H2O═SO42-+2Cl-+2H+ | |
| B. | 废水排出管B处发生的反应为H++OH-═H2O | |
| C. | A处溶液的流量为1.4 mL•s-1 | |
| D. | B处溶液的流量为2.8 mL•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 70% | C. | 47.6% | D. | 52.4% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com