
分析 (1)根据Ka表达式结合电离平衡常数进行计算;当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,结合此时的pH,以及Ksp=c(Mn2+)•c(S2-)进行计算;
(2)已知:H2S(g)?H2(g)+S(g)△H2 2S(g)?S2 (g)△H3,利用盖斯定律来计算2H2S(g)?2H2 (g)+S2 (g)的△H1;
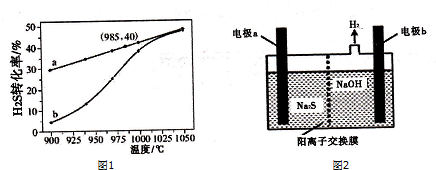
(3)根据温度升高,转化率增大,可知平衡正移,据此分析;根据转化率求出反应的量,再求反应速率;根据温度对速率的影响分析;
(4)阴极上氢离子放电生成氢气,阳极上硫离子放电,电极反应式为S2--2e-═S;Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应,同时S元素得电子生成H2S,根据电解原理来回答.
解答 解:(1)已知:H2S电离常数:K1=1.3×10-7,250C时,0.1mol.L-1H2S溶液中,设氢离子浓度是x,根据H2S?2H++HS-,则:$\frac{{x}^{2}}{0.1}$=1.3×10-7,解得x=$\sqrt{1.3}$×10-4,所以pH≈4,当Qc=Ksp(MnS)时开始沉淀,调节溶液的pH=5,H2S电离常数:K2=7.0×10-15,当HS-浓度为1.0×10-4mol•L-1时,c(S2-)=7×10-12mol•L-1,
所以Ksp=c(Mn2+)•c(S2-)=7×10-12mol•L-1×0.020mol.L-1=2.8×10-13,故答案为:4;2.8×10-13;
(2)已知:①H2S(g)?H2(g)+S(g)△H2
②2S(g)?S2 (g)△H3
反应:2H2S(g)?2H2 (g)+S2 (g)可以根据①×2+②得到,所以△H1=2△H2+△H3,故答案为:△H1=2△H2+△H3;
(3)由图象可知,温度升高,转化率增大,则平衡正移,所以正方向为吸热方向,即△H>0,H2S的起始浓度均为c mol•L-1,若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则参加反应的硫化氢为c mol•L-1×40%=0.4cmol•L-1,v=$\frac{△c}{△t}$=$\frac{0.4c}{t}$mol•L-1•min-1;以H2S起始浓度均为cmol•L-1测定H2S的转化率,985℃时H2S的转化率为40%,则
2H2S(g)?2H2(g)+S2(g),
开始 c 0 0
转化 0.4c 0.4c 0.2c
平衡0.6c 0.4c 0.2c
K=$\frac{0.2c×(0.4c)^{2}}{(0.6c)^{2}}$=$\frac{0.8c}{9}$;随着温度升高,反应速率逐渐加快,达到平衡所需时间缩短,所以曲线b向曲线a逼近;
故答案为:>;$\frac{0.4c}{t}$;$\frac{0.8c}{9}$;温度升高,反应速率加快,达到平衡所需时间缩短.
(4)电解过程中阳极区发生如下反应:S2--2e-═S,溶液中发生反应(n-1)S+S2-═Sn2-,故答案为:(n-1)S+S2-═Sn2-.
点评 本题考查了化学平衡及其影响,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握三段式在化学计算中的应用方法,试题培养了学生分析能力及化学计算能力.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 全部可以 | B. | ④⑦可以 | C. | ②⑧可以 | D. | ①②③⑥可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 碱性的废水 | 用CO2中和 | 化学法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 废酸 | 加生石灰中和 | 化学法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:| MnO2的质量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2体积/mL | 49 | 61 | 86 |
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.
煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.| 时间/min | 0 | 1 | 3 | 8 | 11 |
| n(H2)mol | 8 | 6 | 3 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com