
| A. | 16.5克过氧化钾晶体中,含0.3NA个阴离子 | |
| B. | 1mol铜粉与硫粉充分反应可转移2mol电子 | |
| C. | 含等物质的量溶质的NaHSO4溶液和Na2SO4 溶液中,均含2NA个阳离子 | |
| D. | 20 g NH3T+中含有中子数为9NA |
分析 A、求出过氧化钾的物质的量,然后根据1mol过氧化钾中含2mol钾离子和1mol过氧根来分析;
B、铜和硫反应后变为+1价;
C、NaHSO4在溶液中能完全电离为钠离子、氢离子和硫酸根;
D、求出20gNH3T+的物质的量,然后根据1molNH3T+中含9mol中子来分析.
解答 解:A、16.5g过氧化钾的物质的量为n=$\frac{16.5g}{110g/mol}$=0.15mol,而1mol过氧化钾中含2mol钾离子和1mol过氧根,故0.15mol过氧化钾中含0.15NA个阴离子,故A错误;
B、铜和硫反应后变为+1价,故1mol铜转移NA个电子,故B错误;
C、NaHSO4在溶液中能完全电离为钠离子、氢离子和硫酸根,故含等物质的量溶质的NaHSO4溶液和Na2SO4 溶液中,含有的阳离子个数相等,但不一定是2NA个,故C错误;
D、20gNH3T+的物质的量为1mol,而1molNH3T+中含9mol中子,故含9NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:填空题
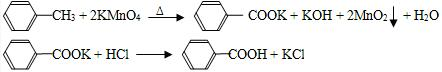
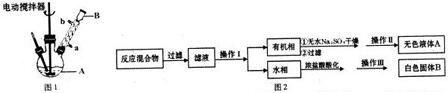
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若1mol A2和1 mol B2的总能量之和大于生成的1 mol AB的总能量,则反应放热 | |
| B. | 若1mol A2和1 mol B2的总能量之和小于生成的2 mol AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2<2Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2<Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物稳定性:PH3>CH4 | |
| B. | HCl的电子式为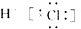 | |
| C. | D2O分子所有原子均达到最外层8e-稳定结构 | |
| D. | VIIA族元素中F的最高价氧化物对应水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
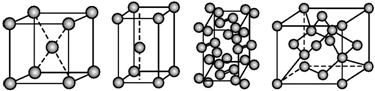
| A. | 碘、锌、钠、金刚石 | B. | 金刚石、锌、碘、钠 | C. | 钠、锌、碘、金刚石 | D. | 锌、钠、碘、金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | KCl | C. | CaCl2 | D. | AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳的比例模型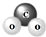 | |
| B. | 原子核内有10个中子的原子:${\;}_{8}^{16}$C | |
| C. | Fe3+的最外层电子排布式为3s23p63d5 | |
| D. | Cu基态的外围电子排布图: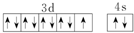 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:Z->Y2- | B. | 原子半径:W>X>Y>Z | ||
| C. | 离子半径:Y2->Z->X+>W3+ | D. | 原子序数d>c>b>a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com