
| A. | ρ=$\frac{(36.5V+22400)c}{V}$ | B. | c=$\frac{1000Vρ}{36.5V+22400}$ | ||
| C. | V=$\frac{22400ω}{36.5(1-ω)}$ | D. | ρ=$\frac{36.5c}{1000ω}$ |
分析 A.根据n=$\frac{V}{{V}_{m}}$计算HCl的物质的量,根据m=nM计算HCl的质量,根据m=ρV计算水的质量,根据V=$\frac{n}{c}$计算溶液的体积,再根据ρ=$\frac{m}{V}$计算溶液的密度;
B.根据n=$\frac{V}{{V}_{m}}$计算HCl的物质的量,根据m=nM计算HCl的质量,根据m=ρV计算水的质量,根据V=$\frac{m}{ρ}$计算溶液的体积,再根据c=$\frac{n}{V}$计算溶液的物质的量浓度;
C.根据n=$\frac{V}{{V}_{m}}$计算HCl的物质的量,根据m=nM计算HCl的质量,根据m=ρV计算水的质量,再根据m(溶质)=m(溶液)•w(溶质)计算;
D.根据c=$\frac{1000ρw}{M}$计算判断.
解答 解:A.VL HCl的物质的量=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,其质量=$\frac{V}{22.4}$mol×36.5g/mol=$\frac{36.5V}{22.4}$g,1L水的质量=1000mL×1g/mol=1000g,故溶液质量=($\frac{36.5V}{22.4}$+1000)g,溶液体积=$\frac{\frac{V}{22.4}mol}{cmol/L}$=$\frac{V}{22.4c}$L,故溶液密度ρ=$\frac{(\frac{36.5V}{22.4}+1000)g}{\frac{V}{22.4c}×1{0}^{3}ml}$=$\frac{(36.5V+22400)c}{1000V}$g/mL,故A错误;
B.VL HCl的物质的量=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,其质量=$\frac{V}{22.4}$mol×36.5g/mol=$\frac{36.5V}{22.4}$g,1L水的质量=1000mL×1g/mol=1000g,故溶液质量=($\frac{36.5V}{22.4}$+1000)g,溶液体积=$\frac{(\frac{36.5V}{22.4}+1000)g}{1000ρg/L}$=$\frac{36.5V+22400}{22400ρ}$L,故溶液浓度c=$\frac{\frac{V}{22.4}}{\frac{36.5V+22400}{22400ρ}}$=$\frac{1000Vρ}{36.5V+22400}$mol/L,故B正确;
C.VL HCl的物质的量=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,其质量=$\frac{V}{22.4}$mol×36.5g/mol=$\frac{36.5V}{22.4}$g,1L水的质量=1000mL×1g/mol=1000g,故溶液质量=($\frac{36.5V}{22.4}$+1000)g,则:($\frac{36.5V}{22.4}$+1000)g×w=$\frac{36.5V}{22.4}$g,解得V=$\frac{22400ω}{36.5(1-ω)}$,故C正确;
D.根据c=$\frac{1000ρw}{M}$可知,ρ=$\frac{36.5c}{1000w}$,故D正确,
故选A.
点评 本题考查物质的量浓度计算,属于字母型计算,为易错题目,注意对公式的理解与灵活应用,难度中等.


科目:高中化学 来源: 题型:解答题
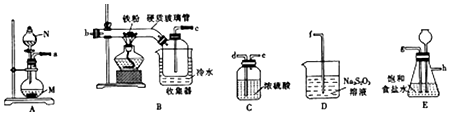
| 实验 | 操作 | 现象 | |
| 实验I(取褪色后溶液3等份) | 第1份 | 滴加FeCl3溶液 | 无明显变化 |
| 第2份 | 滴加KSCN溶液 | 溶液出现红色 | |
| 第3份 | 滴加稀盐酸和BaCl2 | 产生白色沉淀 | |
| 实验Ⅱ(取褪色后溶液同浓度的FeCi3溶液) | 滴加2KSCN溶液,溶液变红,再通入O2 | 无明显变化 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
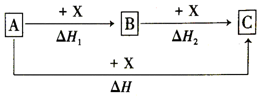
| A. | ②③④⑥ | B. | ②③④⑤⑥ | C. | ①②③④⑥ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
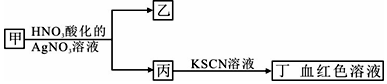
| A. | 若乙为白色沉淀,则甲中可能含有SiO32- | |
| B. | 若乙为淡黄色沉淀,则甲中可能含有FeBr3 | |
| C. | 若乙为淡黄色沉淀,则甲中可能含有S2- | |
| D. | 若乙为白色沉淀,则甲中一定含有FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 除去蛋白质中混有的(NH4)2SO4 | 将混合物装入半透明袋,并放入流动的蒸馏水中 |
| B | 除去Mg粉中混有Al粉 | 加入足量NaOH溶液,过滤、洗涤、干燥 |
| C | 用苯萃取溴水中的Br2 | 先从分液漏斗下口放出水层,再从上口倒出有机层 |
| D | 测定NaClO溶液中的pH | 用玻璃棒蘸取溶液点滴在pH试纸上,与标准比色卡对照 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质颗粒直径都在1~100nm之间 | B. | 都能透过半透膜 | ||
| C. | 都是均一、稳定的液体 | D. | 都能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子式为C9H11O5 | |
| B. | 可以分别与乙醇、乙酸在一定条件下反应,且反应类型相同 | |
| C. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同 | |
| D. | 含有苯环的酯的同分异构体有4种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com