
分析 原溶液中n(SO42-)=n(BaCl2)=0.4L×4mol/L=1.6mol,
假设原溶液中只有CuSO4,由Fe+Cu2+=Cu+Fe2+可知,则参加反应的n(Fe)=n(CuSO4)=1.6mol,反应的铁粉质量为:1.6mol×56g/mol=89.6g,
假设原溶液中只有Fe2(SO4)3,由Fe+Fe2(SO4)3=3FeSO4可知,则参加反应的n(Fe)=1.6mol×$\frac{1}{3}$,反应的铁粉质量为:1.6mol×$\frac{1}{3}$×56g/mol=22.9g,
所以21.7g铁粉会完全反应,没有剩余,最后得到16.8g残留固体为铜,
因氧化性Fe3+>Cu2+,则加入铁粉,先发生Fe+Fe2(SO4)3=3FeSO4,Fe3+反应完毕后发生Fe+CuSO4=FeSO4+Cu,根据方程式计算生成16.8gCu消耗Fe的质量,进而计算与Fe2(SO4)3反应消耗Fe的质量,根据方程式计算n[Fe2(SO4)3],再根据硫酸根守恒计算n(CuSO4),根据c=$\frac{n}{V}$计算它们的浓度.
解答 解:原溶液中n(SO42-)=n(BaCl2)=0.4L×4mol/L=1.6mol,
假设原溶液中只有CuSO4,由Fe+Cu2+=Cu+Fe2+可知,则参加反应的n(Fe)=n(CuSO4)=1.6mol,反应的铁粉质量为:1.6mol×56g/mol=89.6g,
假设原溶液中只有Fe2(SO4)3,由Fe+Fe2(SO4)3=3FeSO4可知,则参加反应的n(Fe)=1.6mol×$\frac{1}{3}$,反应的铁粉质量为:1.6mol×$\frac{1}{3}$×56g/mol=22.9g,
所以21.7g铁粉会完全反应,没有剩余,最后得到16.8g残留固体为铜,
Fe+CuSO4=FeSO4+Cu
56 64
m(Fe) 16.8g
m(Fe)=$\frac{16.8g×56}{64}$=14.7g
与Fe2(SO4)3反应的铁粉质量为21.7g-14.7g=7g,
Fe+Fe2(SO4)3=3FeSO4
56g 1mol
7g n[Fe2(SO4)3]
所以 n[Fe2(SO4)3]=$\frac{7g×1mol}{56g}$=0.125mol,
故c故原溶液中c[Fe2(SO4)3]=$\frac{0.125mol}{0.5L}$=0.25mol/L,
根据硫酸根守恒,则n(CuSO4)=1.6mol-0.125mol×3=1.225mol,则c(CuSO4)=$\frac{1.225mol}{0.5L}$=2.45mol/L,
答:原混合液中CuSO4为2.45mol/L,Fe2(SO4)3为0.25mol/L
点评 本题考查混合物计算,难度中等,判断残留固体的成分是关键,注意硫酸铜不一定完全反应.


科目:高中化学 来源: 题型:选择题
| A. | ①和③ | B. | ①和④ | C. | ②和③ | D. | ②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素性质 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 0.89 | 0.82 | 0.77 | 0.99 | 0.75 | 1.17 | 1.43 |
| 最高或最低化合价 | +2 | +3 | +4 | +7 | +5 | +4 | +3 | |
| -2 | -4 | -1 | -3 | -4 |

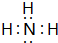 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )
浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )| A. | 实验开始时需给a试管稍微加热 | |
| B. | 反应开始时铜片表面可以看到有黑色物质生成 | |
| C. | 将a试管里的溶液冷却后注入盛有水的烧杯中,溶液呈蓝色 | |
| D. | b试管中的溶液逐渐褪为无色,说明反应生成的气体,将品红氧化为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A. | 反应在0~3 s内的平均速率v(NO2)=0.24 mol•L-1•s-1 | |
| B. | 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍 | |
| D. | 在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}Cl$ | B. | 四氯化碳的电子式: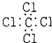 | ||
| C. | 铝原子的结构示意图: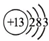 | D. | 二氧化碳的结构式:O-C-O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 主族元素的原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 稀有气体原子的最外层电子数都是8 | |
| D. | 互为同位素的元素物理性质、化学性质均相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com