
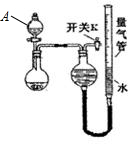
| 实验 | 药品 | 制取气体 | 量气管中液体 |
| Ⅰ | Cu,稀HNO3 | NO | H2O |
| Ⅱ | NaOH(s),浓氨水 | NH3 | |
| Ⅲ | 镁铝合金、NaOH溶液 | H2 | H2O |

| 编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
 可知,仪器A的名称为分液漏斗,
可知,仪器A的名称为分液漏斗,| (346.3-10.0)+(345.7-10) |
| 2 |
| 54g×0.336L |
| 3×33.4L |
| 0.27g |
| 1.0g |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
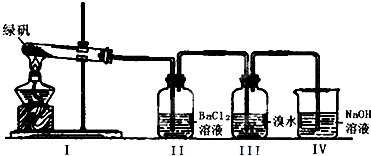
| 实验步骤 | 实验预期现象及结论 |
| 步骤一:取少量的FeSO4固体与试管中,加入一定量水溶解. | \ |
| 步骤二: |
查看答案和解析>>
科目:高中化学 来源: 题型:
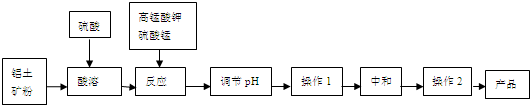
| n(MnO2) |
| n(Fe) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Ba2+、Cl-、NO3- |
| B、K+、Na+、Br-、S2- |
| C、H+、Fe3+、I-、NO3- |
| D、Na+、Ba2+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com