
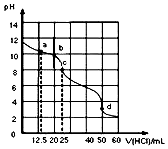
 常温下,用0.1000mol•L-1盐酸滴定25mL0.1000mol•L-1Na2CO3溶液,其滴定曲线如图所示,对滴定过程中所得溶液相关离子浓度间的关系,下列有关说法正确的是( )
常温下,用0.1000mol•L-1盐酸滴定25mL0.1000mol•L-1Na2CO3溶液,其滴定曲线如图所示,对滴定过程中所得溶液相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(Cl-)>c(HCO3-)>c(CO32-) | |
| B. | b点:c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | c点:c(CO32-)+c(OH-)=c(H+)+c(H2CO3) | |
| D. | d点:c(Na+)=0.1000mol•L-1 |
分析 A.a点n(HCl)=0.1000mol/L×0.0125L=0.00125mol,n(Na2CO3)=0.1000mol/L×0.025L=0.0025mol,反应生成0.00125molNaCl和NaHCO3,剩余0.00125molNa2CO3,碳酸钠的水解程度大于碳酸氢钠,则c(HCO3-)>c(C032-),结合物料守恒判断;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3;
D.d点n(HCl)=0.1000mol/L×0.050L=0.005mol,为碳酸钠物质的量的二倍,二者反应方程式为Na2CO3+2HCl=2NaCl+CO2+H2O,溶液中的溶质为NaCl,根据物料守恒判断.
解答 解:A.a点n(HCl)=0.1000mol/L×0.0125L=0.00125mol,n(Na2CO3)=0.1000mol/L×0.025L=0.0025mol,反应生成0.00125molNaCl和NaHCO3,剩余0.00125molNa2CO3,碳酸根离子水解程度大于碳酸氢根离子,所以c(CO32-)<c(HCO3-),根据物料守恒可知:c(HCO3-)>c(Cl-)>c(C032-),故A错误;
B.b点时根据电荷守恒可知:c(Na+)+c(H+)=c(Cl一)+c(HCO3-)+2c(CO32-)+c(OH-),故B错误;
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3,根据质子守恒得c(OH-)+c(CO32-)=c(H+)+c(H2CO3),故C正确;
D.d点n(HCl)=0.1000mol/L×0.050L=0.005mol,为碳酸钠物质的量的二倍,二者反应方程式为 Na2CO3+2HCl=2NaCl+CO2+H2O,溶液中的溶质为NaCl,根据物料守恒得c(Na+)=c(Cl-)=$\frac{0.005mol}{0.075L}$=0.07mol/L,故D错误;
故选C.
点评 本题考查离子浓度大小比较,题目难度中等,明确反应物的物质的量相对大小及溶液中的溶质成分是解本题关键,再结合守恒思想解答,注意掌握盐的水解原理及其影响,试题培养了学生的分析能力及灵活应用能力.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 该固体中只含有NH4+、Cl-、CO32-、SO42- | |
| B. | 该固体中一定没有Cu2+、Na+、Ba2+、Cl- | |
| C. | 该固体中一定含有NH4+、Na+、CO32-、SO42- | |
| D. | 根据以上实验,无法确定该固体中含有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 钢铁易生锈是因为在潮湿的空气里,其表面吸附一层薄薄的水膜,构成了若干微小原电池(如图所示).下列有关说法正确的是( )
钢铁易生锈是因为在潮湿的空气里,其表面吸附一层薄薄的水膜,构成了若干微小原电池(如图所示).下列有关说法正确的是( )| A. | O2在正极参加反应,生成OH- | |
| B. | 钢铁生锈过程中电能转化为化学能 | |
| C. | 负极的电极反应式为:Fe-3e -=Fe3+ | |
| D. | 为减缓铁制品生锈,可将其与铜相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )| A. | (1)(2)(3)(4) | B. | (2)(4)(5) | C. | (2)(3)(4) | D. | (1)(2)(3)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解时阴极上无金属析出的溶液:Al3+、Zn2+、Cl-、SO42- | |
| B. | 加入铁粉有氢气生成的溶液:Mg2+、K+、NO3- | |
| C. | 通入SO2后无沉淀生成的溶液:Ba2+、Fe3+、Cl-、NO3- | |
| D. | 常温下,水电离出的c(H+)=1×10-12mol/L的溶液中:Cl-、I-、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为113 | B. | 质子数为113 | ||
| C. | 相对原子质量为113 | D. | 中子数为113 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硝酸钠是重要的防腐剂.亚硝酸钠外观与食盐非常相似,毒性较强,所以必须加以区分.以下是常用的两种鉴别NaCl和NaNO2 的方法:
亚硝酸钠是重要的防腐剂.亚硝酸钠外观与食盐非常相似,毒性较强,所以必须加以区分.以下是常用的两种鉴别NaCl和NaNO2 的方法:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com