
【题目】已知氯的非金属性比氮的强,某同学依据反应3Cl2+2NH3=6HCl+N2进行实验证,设计的实验装置如下:
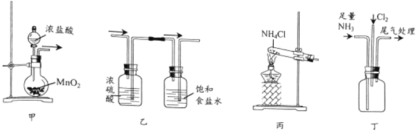
下列说法正确的是
A.可用图甲所示装置及药品制取Cl2B.可用图乙所示装置及气流方向净化Cl2
C.可用图丙所示装置及药品制取NH3D.可用图丁所示装置进行实验,瓶中有白烟产生
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 24.60 |
回答下列问题:
(1)如图中甲为___________滴定管,乙为_________ 滴定管(填“酸式”或“碱式 ”)
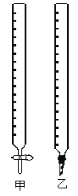
(2)实验中,需要润洗的仪器是:________________________
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是________________________________________
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果____________(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果___________。
(5) 未知浓度的NaOH溶液的物质的量浓度为_____________mol/l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组为了探究氨气的氧化性设计了如下实验方案。
已知:①铝可以与氨气反应2Al+2NH3![]() 2AlN+3H2;
2AlN+3H2;
②氮化铝性质稳定,基本不与水、酸反应,在加热时溶于浓碱,可产生氨气。
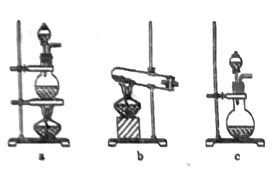
(1)上图是实验室制备氨气的常用发生装置,若选择装置b,则该发生装置中的化学反应方程式为:___________________________。
(2)若将装置c改进,按下图所示连接好装置,检査装置气密性;在蒸馏烧瓶中加入生石灰,分液漏斗中加入浓氨水,装置G中盛装碱石灰,装置H中加入铝粉。打开装置F处分液漏斗活塞,待装置中空气排尽后,再点燃装罝H处酒精灯。
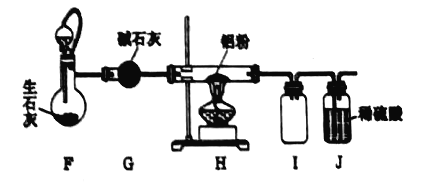
①装置F与装置c相比的优点: ____________________________。
②用平衡移动原理解释装置F中产生氨气的原因: __________________________。
③为了得到纯净的氮化铝,可将装置H中固体冷却后转移至烧杯中,加入_______溶解、__________(填操作名称)、洗涤、干燥即可。
④氮化铝与氢氧化钠溶液共热反应的离子方程式: __________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是氧化性酸,其本质是NO![]() 有氧化性,某课外实验小组进行了下列有关NO
有氧化性,某课外实验小组进行了下列有关NO![]() 氧化性的探究(实验均在通风橱中完成)。
氧化性的探究(实验均在通风橱中完成)。
实验装置 | 编号 | 溶液X | 实验现象 |
| 实验Ⅰ | 6mol·L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色。 |
实验Ⅱ | 15mol·L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色。 |
⑴写出铜与稀硝酸反应的离子方程式_____。
⑵实验Ⅰ中,铝片作_____(填“正”或“负”)极。液面上方产生红棕色气体的化学方程式是_____。
⑶实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是______。
查阅资料:活泼金属与1mol·L-1稀硝酸反应有H2和NH![]() 生成,NH
生成,NH![]() 生成的原理是产生H2的过程中NO
生成的原理是产生H2的过程中NO![]() 被还原。
被还原。
⑷用如图装置进行实验Ⅲ:溶液X为1mol·L-1稀硝酸溶液,观察到电流计指针向右偏转。反应后的溶液中含NH![]() 。生成NH
。生成NH![]() 的电极发生的反应是_____(填“氧化反应”或“还原反应”)。
的电极发生的反应是_____(填“氧化反应”或“还原反应”)。
⑸进一步探究碱性条件下NO![]() 的氧化性,进行实验Ⅳ(如图):
的氧化性,进行实验Ⅳ(如图):
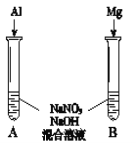
①观察到A中有NH3生成,B中无明显现象。A、B产生不同现象的原因是_____。
②A中生成NH3的离子方程式是______。
⑹将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的反应装置如图所示,步骤之一是将仪器a中浓硝酸和浓硫酸形成的混酸加入到装有苯的三颈烧瓶中,则下列叙述不正确的是( )
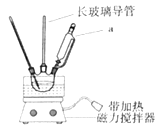
A.仪器a的名称是恒压滴液漏斗
B.长玻璃导管可以起到冷凝回流的作用
C.配制混酸时应在烧杯中先加入浓硫酸
D.分离出硝基苯的主要操作是分液和蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO3(g)![]() 2SO2(g) + O2(g)的能量与反应进程如图(a) 所示;在恒容密闭容器中充入SO3(g),T1°C测得其中的SO3(g)和O2(g)的浓度随时间变化如图(b) 所示。下列说法正确的是
2SO2(g) + O2(g)的能量与反应进程如图(a) 所示;在恒容密闭容器中充入SO3(g),T1°C测得其中的SO3(g)和O2(g)的浓度随时间变化如图(b) 所示。下列说法正确的是
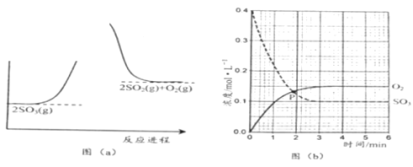
A.由图(a) 知,正反应为放热反应
B.图(b)中,SO3分解的平均速率0~1min比1~2min慢
C.图(b)中,P点时反应达到平衡状态
D.由图(b)知,SO2的平衡浓度为0.3mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL 0.1 mol/L的CuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)随滴入的Na2S溶液体积的变化如图所示(忽略滴加过程中的温度变化和溶液体积变化)。下列叙述正确的是( )
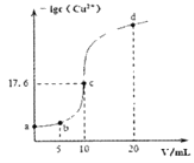
A. 常温下Ksp (CuS)的数量级为10-30
B. c点溶液中水的电离程度大于a点和d点溶液
C. b点溶液中c(Na+)=2c(Cl-)
D. d点溶液中c (Na+) >c (Cl-) >c (S2-) >c (OH-) >c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年获诺贝尔化学奖的是约翰·班尼斯特·古迪纳夫(John B.Goodenough)、迈克尔·斯坦利·威廷汉(M.Stanley Whittlingham)和吉野彰( Akira Yoshino)三位科学家,他们在锂离子电池发展上做出了突出贡献。锂离子电池是将层状石墨加导电剂及黏合剂涂在铜箔基带上,将钴酸锂(LiCoO2)涂在铝箔上制作而成,利用锂离子在两极上的嵌入和脱嵌进行充、放电,其原理如图所示。下列说法错误的是

LiCoO2+6C=Li1-xCoO2+LixC6
A.石墨加导电剂及黏合剂涂在铜箔基带上作锂离子电池的负极
B.充电时Li+从石墨层状结构中脱嵌,进入电解质
C.放电时的正极反应为Li1-xCoO2+xLi++xe-=LiCoO2
D.锂离子电池常用非水液态有机电解质作电解液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高分子化合物R的结构简式如图,下列有关R的说法正确的是

A. R的单体之一的分子式为C9H12O2
B. R可通过加聚和缩聚反应合成,R完全水解后生成2种产物
C. R是一种有特殊香味,难溶于水的物质
D. 碱性条件下,1 mol R完全水解消耗NaOH的物质 的量为n(m+1)mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com