
【题目】下列化学用语正确的是
A. 氯化钠的电子式:![]() B. 氯原子的结构示意图:
B. 氯原子的结构示意图:![]()
C. 乙烯的结构简式:CH2CH2 D. 质子数为35、中子数为45的溴原子: ![]()
【答案】D
【解析】A.氯化钠是由钠离子和氯离子构成的,电子式中需要标出所带电荷,氯离子还需要标出最外层电子,其正确的电子式为![]() ,故A错误;B.氯原子是17号元素,核外电子分为三个电子层,K层2个电子,L层8个电子,M层7个电子,其正确的原子结构示意图为:
,故A错误;B.氯原子是17号元素,核外电子分为三个电子层,K层2个电子,L层8个电子,M层7个电子,其正确的原子结构示意图为: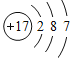 ,故B错误;C.乙烯分子中含有碳碳双键,乙烯正确的结构简式为:CH2=CH2,故C错误;D.元素符号左下角数字表示质子数、左上角数字表示质量数,质子数为35、中子数为45的溴原子的质量数=35+45=80,所以该溴原子可以表示为:
,故B错误;C.乙烯分子中含有碳碳双键,乙烯正确的结构简式为:CH2=CH2,故C错误;D.元素符号左下角数字表示质子数、左上角数字表示质量数,质子数为35、中子数为45的溴原子的质量数=35+45=80,所以该溴原子可以表示为: ![]() ,故D正确;故选D。
,故D正确;故选D。
点晴:本题考查了常见的化学用语的判断。本题的易错点为C,要注意书写结构式、结构简式时首先要明确原子间结合顺序(如HClO应是H—O—Cl,而不是H—Cl—O),其次是书写结构简式时,碳碳双键、碳碳三键应该写出来。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上可用铬铁矿(主要成分可表示为FeO·Cr2O3,还含有Al2O3、MgCO3、SiO2等杂质)为原料制备重铬酸钾晶体和绿矾的流程如下:
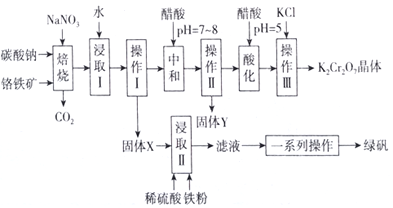
已知:Ⅰ.常见离子沉淀的pH范围
Fe3+ | Al3+ | Mg2+ | SiO32- | AlO2- | |
开始沉淀 | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
沉淀完全 | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
Ⅱ.焙烧过程中主要发生反应:2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2Cr2O4+Fe2O3+4CO2↑+7NaNO2。
(1)绿矾的化学式为________。
(2)焙烧后的混合物中除含有Na2Cr2O4、NaNO2和过量的Na2CO3、NaNO3外,还含有NaAlO2和Na2SiO3等物质,则焙烧过程中NaAlO2的化学方程式为___________________________。
(3)固体Y的主要成分为________(填写化学式)。
(4)酸化过程中用醋酸调节pH=5的目的为________________________;若pH调节的过低,NO2-可被氧化为NO3-,其离子方程式为_________________________________。
(5)调节pH=5后,加入KCl控制一定条件,可析出K2Cr2O7晶体,说明溶解度的大小:K2Cr2O7________Na2Cr2O7(填“大于”或“小于”)。
(6)流程中的一系列操作为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢制构件在镀锌前需要经过酸洗,其基本原理是用盐酸除去其表面的Fe2O3·H2O及FeO等杂质。回收废酸同时生产含铁产品的流程如下:

已知:
i.酸洗钢制构件后得到废酸的主要成分如下表所示。

ii.pH <4时,Fe2+不易被氧气氧化。
(1)用离子方程式解释废酸中不含Fe3+的原因______________________________。
(2)过程II中,发生的主要反应:FeCl2(s)十H2SO4(aq) ![]() FeSO4(s)+2HCl( aq)。
FeSO4(s)+2HCl( aq)。
①加入过量H2SO4的作用是__________________________________(写出一点即可)。
②用化学平衡原理解释鼓入空气的目的:_________________________________。
(3)过程III中,FeSO4隔绝空气焙烧得到的尾气中含有两种可用于生产硫酸的氧化物,此过程发生反应的化学方程式是_________________________________________。
(4)过程V:阴离子交换树脂可将FeCl4-选择性吸附分离,其过程可表示为ROH +X-![]() RX +OH-(X-表示FeCl4-)。当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:FeCl4-
RX +OH-(X-表示FeCl4-)。当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:FeCl4-![]() Fe3+ +4C1-。
Fe3+ +4C1-。
①吸附后溶液的pH将会_______________。(填“升高”、“降低”或“不变”)
②洗脱液经处理后有许多用途,下列用途合理的是_________________。
A、刻蚀印刷铜线路板 B、净化污水 C、自来水消毒 D、浸泡生物标本
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X的结构简式为 。下列有关有机物X的说法正确的是
。下列有关有机物X的说法正确的是
A. 有机物X 的分子式为C15H10O5
B. 与浓溴水反应,1 mol有机物X最多消耗8 mol Br2
C. 一定条件下,1 mol有机物X最多能与8 mol H2反应
D. 1 mol有机物X最多能与5 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期元素,其原子半径、化合价等信息见下表。

有关这四种元素的说法一定正确的是
A. X与W形成的化合物的电子式可表示为![]()
B. Y的氢化物能与W的氢化物反应,所得产物只含有共价键
C. X、Y能分别与氧元素形成多种氧化物
D. Z处于元素周期表中第三周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,由N2O和CO2组成的混合气体的密度是C2H4、N2和H2组成的混合气体密度的 2倍,则C2H4、N2和H2组成的混合气体中H2的质量分数为
A. 3/13 B. 10/13 C. 大于3/13,小于10/13 D. 3/143
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题:
(1)Cu2O中阳离子的基态核外电子排布式为__________________; Cu和Ni在元素周期表中的位置相邻, Ni在周期表中的位置是__________________。
(2)将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体 [Cu( NH3)4]SO4·H2O。
①乙醇分子中C 原子的轨道杂化类型为__________________,NH3与H+以配位键形成NH4+,则NH4+的空间构型为____________________。
②[Cu( NH3)4]SO4·H2O]中存在的化学键除了极性共价键外,还有____________________。
③NH3极易溶于水的原因主要有两个,一是_______________,二是_______________________。
(3)CuSO4溶液中加入过量KCN溶液能生成配离子[Cu(CN)4]2-,1mol CN-中含有的π键数目为__________。与CN-互为等电子体的离子有____________(写出一种即可)。
(4)Cu 与F形成的化合物的晶胞结构如图所示,若晶体密度为a g·cm-3,则Cu与F最近距离为____________pm(用NA表示阿伏加德罗常数的值,列出计算表达式,不用化简)。
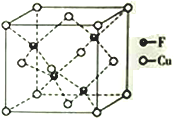
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图Ⅰ、Ⅱ分别是甲、乙两组同学将反应 “AsO43-+2I-+2H+![]() AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
下列叙述中正确的是( )
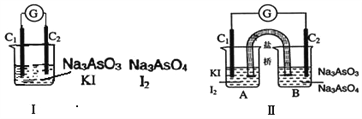
A. 甲组操作时,微安表(G)指针发生偏转
B. 甲组操作时,溶液颜色变浅
C. 乙组操作时,C2做正极
D. 乙组操作时,C1上发生的电极反应为I2+2e-=2I-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com