
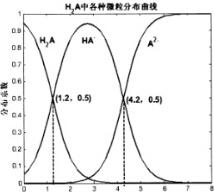
 常温下0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分数系数)随pH变化的关系如图所示.下列表述不正确的是( )
常温下0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分数系数)随pH变化的关系如图所示.下列表述不正确的是( )| A. | H2A?2H++A2- K=10-5.4 | |
| B. | 在0.1mo/LNaHA溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 已知25℃时HF的Ka=10-3.45,将少量H2A的溶液加入足量的NaF溶液中,发生的反应为:H2A+F-═HF+HA- | |
| D. | 将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2 |
分析 由图象可知,pH=1.2时,溶液中存在H2A、HA-,且二者浓度相等,说明H2A部分电离,电离方程式为H2A?H++HA-,则K1=$\frac{c({H}^{+})c(H{A}^{-})}{c({H}_{2}A)}$=10-1.2,
pH=4.2时,HA-、A2-浓度相等,且二者浓度相等,电离方程式为HA-?H++A2-,则K2=$\frac{c({H}^{+})c({A}^{2-})}{c(H{A}^{-})}$=10-4.2,以此解答该题.
解答 解:由图象可知,pH=1.2时,溶液中存在H2A、HA-,且二者浓度相等,说明H2A部分电离,电离方程式为H2A?H++HA-,则K1=$\frac{c({H}^{+})c(H{A}^{-})}{c({H}_{2}A)}$=10-1.2,
pH=4.2时,HA-、A2-浓度相等,且二者浓度相等,电离方程式为HA-?H++A2-,则K2=$\frac{c({H}^{+})c({A}^{2-})}{c(H{A}^{-})}$=10-4.2,
A.H2A部分电离,电离方程式为H2A?H++HA-,故A错误;
B.pH=4.2时,HA-、A2-浓度相等,溶液呈酸性,说明HA-电离程度大于HA-水解程度,则在0.1mo/LNaHA溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+),因还存在水的电离,则c(H+)>c(A2-)>c(OH-),故B正确;
C.已知25℃时HF的Ka=10-3.45,由以上信息可知K1=$\frac{c({H}^{+})c(H{A}^{-})}{c({H}_{2}A)}$=10-1.2,K2=$\frac{c({H}^{+})c({A}^{2-})}{c(H{A}^{-})}$=10-4.2,则酸性H2A>HF>HA-,则将少量H2A的溶液加入足量的NaF溶液中,发生的反应为:H2A+F-═HF+HA-,故C正确;
D.将等物质的量的NaHA、Na2A溶于水中,HA-、A2-浓度相等,K2=$\frac{c({H}^{+})c({A}^{2-})}{c(H{A}^{-})}$=10-4.2,则c(H+)=10-4.2mol/L,pH为4.2,故D正确.
故选A.
点评 本题考查了离子浓度大小比较,为高频考点,侧重学生的分析、计算能力的考查,明确图象中曲线变化的含义为解答关键,根据图象掌握平衡常数的应用为解答该题的关键,难度中等.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X极为负极,Y极为正极 | |
| B. | 工作一段时间后,KOH的物质的量不变 | |
| C. | 电池工作时甲烷一极附近溶液的pH减小 | |
| D. | 该在标准状况下通入5.6 L O2完全反应,则有1.0mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
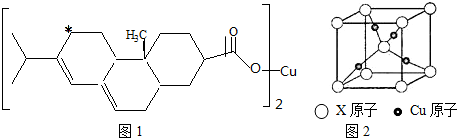
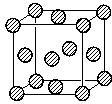 ,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果).$\root{3}{\frac{257}{8.5{N}_{A}}}$.
,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果).$\root{3}{\frac{257}{8.5{N}_{A}}}$.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国2015年玉月1日正式实施的《环境保护法》被称为“史上最严”环保法,为保护好环境,工业生产应从源头上减少或尽量消除生产对环境的污染 | |
| B. | 在某爆炸事故救援现场,消防员发现存放金属钠、电石、甲苯二异氰酸酯 等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 | |
| C. | 世界卫生组织认为青蒿素(结构如右图所示)联合疗法是当下治疗疟疾最 有效的手段,已经拯救了上百万生命,靑蒿素属于烃类物质 | |
| D. | 某品牌化妆品在广告中反复强调:“十年专注自然护肤”,该产品中不含任何化学成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | SO2通入足量的稀Fe(NO3)3溶液 | 溶液由棕黄色变为浅绿色,但立即又变成棕黄色 | 氧化性:HNO3>稀硫酸>Fe3+ |
| B | 相同条件下,测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| C | 将表面氧化的铜丝从酒精灯的外焰慢慢移向内焰 | 黑色的铜丝变红色 | 氧化铜被酒精灯内焰的乙醇蒸汽还原 |
| D | 取适量NH4Al(SO4)2样品置于试管中加水溶解,滴加少量稀NaOH溶液 | 湿润的红色石蕊试纸靠近试管口,试纸变蓝 | NH4Al(SO4)2溶液中存在NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、氯乙烯、丙烯分子中所有原子均在同一平面 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 甲烷、乙烷、丙烷在光照下分别与氯气反应,生成的一氯代物都只有一种 | |
| D. | 乙醇、甲苯和溴苯可用水鉴别 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com