
 | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
分析 1)燃烧热为1mol物质完全燃烧生成温度氧化物的热效应,故可计算1molC2H2完全燃烧生成液态水和二氧化碳气体放出的热量,写出热化学方程式;
(2)原电池负极发生氧化反应,电解质溶液为氢氧化钾溶液,C2H2放电生成2CO32-,利用C元素化合价变化判断失去电子数,根据电荷守恒和质量守恒写出电极反应式;
(3)①计算10min~20min内,NO浓度的变化,得到v(NO);
②利用化学平衡状态的特征判断,正逆反应速率相同,个组分含量保持不变;
③NO的起始浓度增大,体系压强增大,由于反应前后气体体积不变,化学平衡状态不变;
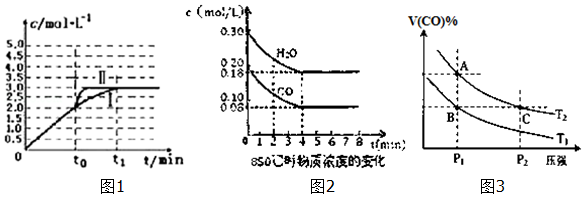
(4)①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,改变条件瞬间CO浓度不变,平衡时CO的浓度不变,改变条件不影响平衡移动,同时缩短到达平衡的时间,升高温度影响平衡移动,反应为气体体积不变的反应,增大压强平衡不移动,但CO的浓度会增大,应是使用催化剂;
②若在t0时刻将容器体积快速压缩至2L(其他条件不变),瞬间CO的浓度变为$\frac{2mol/L×3L}{2L}$=3mol/L,增大压强最终平衡不移动,反应物转化率不变,故平衡时CO的浓度为$\frac{3mol/L×3L}{2L}$=4.5mol/L,反应速率加快,缩短到达平衡时间;
(5)A.由图可知,平衡时△c(CO)=0.2mol/L-0.08mol/L=0.12mol/L,利用浓度变化量之比等于化学计量数之比计算△c(H2),再根据n=cV计算n(H2);
B.850℃时该反应的反应热△H≠-41.2kJ/mol;
C.该反应正反应是放热反应,升高温度平衡向逆反应移动;
D.恒容密闭容器中,若充入氦气,体积不变,各物质的浓度不变,速率不变;
(6)A、C两点温度一样,压强C点大于A点,故反应速率A<C;A、C两点的温度一样,故化学平衡常数不变;状态B到状态A,H2的体积分数增大,使平衡向逆向移动.
解答 解:(1)2.00g的C2H2的物质的量为$\frac{2g}{26g/mol}$=0.077mol,释放热量99.6kJ,则C2H2的燃烧热为$\frac{99.6KJ}{0.077mol}$
=1294.8 kJ/mol,可写出热化学方程式:C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1294.8 kJ/mol,
故答案为:C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1294.8 kJ/mol;
(2)原电池负极发生氧化反应,电解质溶液为氢氧化钾溶液,C2H2放电生成2CO32-,C元素化合价升高了5,即1molC2H2失去10mole-,电极反应式为:C2H2-10e-+14OH-=2CO32-+8H2O,故答案为:C2H2-10e-+14OH-=2CO32-+8H2O;
(3)①10min~20min内,NO浓度的变化为$\frac{1.16mol-0.8mol}{3L}$=0.12mol/L,v(NO)=$\frac{0.12mol/L}{20min-10min}$=0.012mol/(L•min),
故答案为:0.012mol/(L•min);
②A.v(NO)(正)=2v(N2)(逆),速率之比等于计量数之比可知,v(N2)(正)=2v(NO)(正),即v(N2)(正)=v(N2)(逆),反应达到平衡状态,故A正确;
B.容器内CO2和N2的体积比为1:1,不能说明正逆反应速率相同,不能说明反应达到平衡状态,故B错误;
C.反应前后气体质量变化,气体物质的量不变,当混合气体的平均相对分子质量保持不变,反应达到化学平衡状态,故C正确;
D.反应前后气体体积不变,是否达到平衡状态,压强都不发生变化,故D错误;
E.ρ=$\frac{m}{n}$,气体物质的量不变,由于C为固体,则气体总质量m,随着反应进行会发生变化,即密度也会发生变化,当密度不变时,达到化学平衡状态,故E正确;
故选ACE,
故答案为:ACE;
③NO的起始浓度增大,体系压强增大,由于反应前后气体体积不变,化学平衡状态不变,则NO的转化率也不变,故答案为:不变;
(4)①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,改变条件瞬间CO浓度不变,平衡时CO的浓度不变,改变条件不影响平衡移动,同时缩短到达平衡的时间,升高温度影响平衡移动,反应为气体体积不变的反应,增大压强平衡不移动,但CO的浓度会增大,应是使用催化剂,
故答案为:加入催化剂;
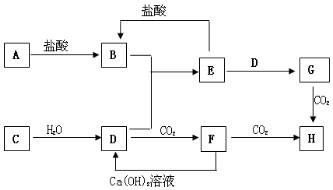
②若在t0时刻将容器体积快速压缩至2L(其他条件不变),瞬间CO的浓度变为$\frac{2mol/L×3L}{2L}$=3mol/L,增大压强最终平衡不移动,反应物转化率不变,故平衡时CO的浓度为$\frac{3mol/L×3L}{2L}$=4.5mol/L,反应速率加快,缩短到达平衡时间,c(CO)随反应时间t变化的曲线为: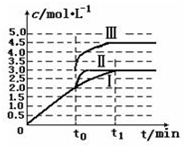 ,
,
故答案为: .
.
(5)A.由图可知,平衡时△c(CO)=0.2mol/L-0.08mol/L=0.12mol/L,浓度变化量之比等于化学计量数之比,故△c(H2)=△c(CO)=0.12mol/L,故n(H2)=0.12mol/L×10L=1.2mol,故A错误;
B.生成1.2mol氢气,通常条件下放出的热量为41.2kJ×$\frac{1.2mol}{1mol}$=49.44kJ,850℃时该反应的反应热△H≠-41.2kJ/mol,故B正确;
C.该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数减小,故C错误;
D.恒容密闭容器中,若充入氦气,体积不变,各物质的浓度不变,速率不变,故D错误;
故答案为:B;
(6)根据图3,A、C两点温度相同,C点的压强大于A点,故反应速率:A<C,B点氢气的含量小于A点的,反应放热,若要提高氢气的含量,必须升高温度;,
故答案为:<; 升温;
点评 本题较为综合,考查了热化学方程式的书写、化学平衡常数、化学平衡状态的判断已经化学平衡移动,难度中等,其中(4)为图象题,具有一定难度.


科目:高中化学 来源: 题型:选择题
| A. | 电解质都易溶于水,所以电解质溶液导电性强 | |
| B. | 250 mL 1 mol/L的Na2SO4溶液中含有的氧原子数为NA | |
| C. | CO2通入澄清石灰水的离子反应方程式为:CO2+Ca(OH)2═CaCO3↓+H2O | |
| D. | S、Fe2+处于中间价态,既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 如图,图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中A、C均为金属单质,C与水反应生成D和最轻的气体,D、H的焰色反应均呈黄色,在通常状况下E(氢氧化物)跟NaOH或盐酸均可发生复分解反应.(反应过程中生成的水及其他产物已略去)
如图,图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中A、C均为金属单质,C与水反应生成D和最轻的气体,D、H的焰色反应均呈黄色,在通常状况下E(氢氧化物)跟NaOH或盐酸均可发生复分解反应.(反应过程中生成的水及其他产物已略去) ;F是Na2CO3.(填化学式)
;F是Na2CO3.(填化学式)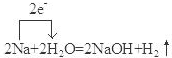 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | Br-Br | H-Br |
| 键能/(kJ•mol-1) | 436 | 193 | 366 |
| A. | +103 kJ•mol-1 | B. | +679 kJ•mol-1 | C. | -103 kJ•mol-1 | D. | +183 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用乙醇的还原性以及Cr3+、Cr2O72-的颜色差异来检验是否酒后驾车 | |
| B. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是产生雾霾天气的主要因素 | |
| C. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+═Cl2↑+H2O | |
| D. | 煤经过气化和液化两个物理变化过程后变为清洁能源,这是煤综合利用的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
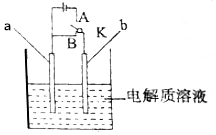 用如图所示装置进行实验,请回答下列问题:
用如图所示装置进行实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,100 mL 1 mol•L-1 FeCl3溶液中含有Fe3+数目小于0.1NA | |
| B. | 1 mol-OH和17 g NH3所含的电子数相等 | |
| C. | 标准状况下,2.24 L Cl2与过量铁粉反应,转移的电子总数为2NA | |
| D. | 常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com