
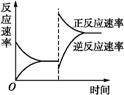
右图是关于反应A2(g)+3B2(g) 2C(g)(正反应为放热反应)的平衡移动图像,影响平衡移动的原因可能是( )。
2C(g)(正反应为放热反应)的平衡移动图像,影响平衡移动的原因可能是( )。
A.升高温度,同时加压 B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度 D.增大反应物浓度,同时使用催化剂
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(1)某反应池发生“生物硝化”过程,利用O2将NH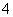 氧化成NO
氧化成NO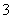 ,如果不考虑过程中硝化细菌的增殖,其反应如下所示:
,如果不考虑过程中硝化细菌的增殖,其反应如下所示:
 请完成上述离子方程式的配平。
请完成上述离子方程式的配平。
(2)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,若I2和KBr的化学计量数分别是8和1,请组成一个配平的化学方程式
________KBrO3+________+________H2SO4―→________+________+________+________+________H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.硅晶体中,有NA个Si就有2NA个Si—Si键
B.同温同压下,相同体积的氟气和氩气所含的原子数相等
C.1 mol CnH2n中含有的共用电子对数为(3n+1)NA
D.在含2 mol H2SO4的浓硫酸中加入足量的Zn粉,充分反应后转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。经小组讨论并验证无色气体为O2,其验证方法是________________________________________________________________________。

(2)[2013·海南17(1)改编]BaCl2·xH2O中结晶水数目可通过重量法来确定;①称取样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置;②过滤并洗涤沉淀;③……
在操作②中,需要先后用稀硫酸和________洗涤沉淀;检验沉淀中氯离子是否洗净的方法是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,可逆反应N2(g)+3H3(g) ===2NH3(g)ΔH<0达到平衡,当单独改变下列
条件后,有关叙述错误的是 ( )
A.加催化剂,v(正)、v(逆)都发生变化,且变化的倍数相等
B.加压,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
C.降温,v(正)、v(逆)都减小,且v(正)减小的倍数小于v(逆)减小的倍数
D.加入氩气,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
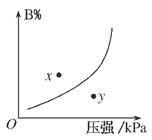
反应mA(s)+nB(g)⇌pC(g)ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
①m+n>p; ②x点表示的正反应速率大于逆反应速率;
③n>p; ④x点比y点时的反应速率慢;
⑤若升高温度,该反应的平衡常数增大。
A.①②⑤ B.只有②④ C.只有①③ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
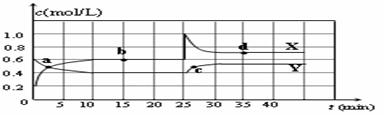 已知NO2和N2O4可以相互转化:2NO2(g)
已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g) 。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,浓度随时间变化关系如右图。
N2O4(g) 。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,浓度随时间变化关系如右图。
⑴ 写出该反应的平衡常数表达式:K= 。 已知: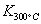 >
>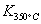 ,则该反应是 热反应。
,则该反应是 热反应。
(2) 不能说明该反应已达到平衡状态的是 。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C. 容器内混合气体的颜色不随时间变化而改变
D. 容器内混合气体的平均分子量不随时间变化而改变
(3) 下列说法正确的是 ( )
A.图中的两条曲线,X是表示NO2浓度随时间的变化曲线
B.前10 min内用v(NO2)表示的化学反应速率为0.06 mol/(L·min)
C.a点 时V(正) = V(逆)
D.a、b、c、d四个点中,只有b、d点的化学反应处于平衡状态
(4) 反应25min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是_________________________________________ _____(用文字表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在一容积可变的容器中,反应2A(g)  B(g)+2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是( )
B(g)+2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是( )
A、充入1mol稀有气体氦(He),平衡将向逆反应方向移动
B、充入A、B、C各1mol,平衡将向正反应方向移动
C、将A、B、C各物质的量都减半,C的百分含量不变
D、加入一定量的A气体达平衡后,C的百分含量一定增加
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示: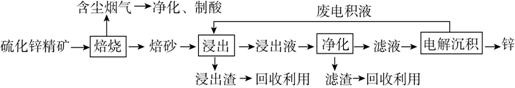
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为____________________。
(2)浸出液“净化”过程中加入的主要物质为________,其作用是________。
(3)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是________。
(4)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生主要反应的离子方程式为___________________________________________。
(5)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。” 该炼锌工艺过程主要反应的化学方程式为_________________________________________________。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
Ⅱ.工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
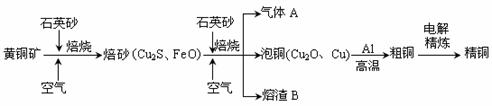
(6) 焙砂含Cu量为20%~50%。转炉中,将焙砂加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。焙砂中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、___________________________;
(7)假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量 mol;
② 6 mol CuFeS2和14.25 mol O2反应,理论上可得到 molCu。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com