
��1��ij��ѧ��ȤС��Ҫ��ɷ�Ӧ�ȵIJⶨ��ʵ�����ϱ����ձ�����С�����ձ�������ĭ���ϡ���ĭ���ϰ塢��ͷ�ιܡ����β�����������0��50mol�� L��1���ᡢ0��50mol�� L��1NaOH��Һ��ʵ����ȱ�ٵIJ�����Ʒ��_____________��_______________��
��2����֪2molCO������ȫȼ������CO2 ����ų�566 kJ������1 mol������ȫȼ������Һ̬ˮ�ų�286 kJ������1 molCH4������ȫȼ������CO2�����Һ̬ˮ�ų�890 kJ������д���ñ�ȼ������Ϊ��Ӧ�ȵ�COȼ�յ��Ȼ�ѧ����ʽ__________________��
��1 molCH4������ȫȼ������CO2�����Һ̬ˮ���ų�����_____890 kJ�� ������� ����������=����������a molCH4��CO��H2�Ļ��������ȫȼ�գ����� CO2�����Һ̬ˮ����CO2��ˮ�����ʵ������ʱ����ų�������Q���ĵ�ȡֵ��Χ��________________��
��1����Ͳ���¶ȼƣ���2�֣�
��2��CO (g)+1/2O2(g)=CO2 (g) ��H="-283" kJ��mol-1 ��2�֣�
> ��2�֣� 284��5a kJ<Q��586��5akJ ��2�֣�
�������������CO2����ת��Ϊ������ҲҪ�ų����������Էų�������890kJ,
CO (g)+1/2O2(g)=CO2(g) ��H="-283" kJ��mol-1 ---------------��1��
H2��g��+1/2 O2��g��=H2O��g����H="-286" kJ��mol-1-----------------��2��
CH4��g��+2 O2��g��=CO2��g��+2H2O ��g����H="-890" kJ��mol-1-------------------��3��
���ɵ�CO2��Һ̬H2O�����ʵ�����ȣ��ü�ֵ�������������¼��ֿ���
1������CO����������
2������H2�����ܣ�CO��CH4��Ϊa/2Ħ
�ų���������Q��=a/2��283+890��=586.5akJ
3������CH4������CO��H2��Ϊa/2Ħ
�ų���������Q��=a/2��283+286��=284.5akJ
�������������������
���Էų���������Q����ȡֵ��ΧΪ�� 284��5a kJ<Q��586��5akJ
���㣺�й��Ȼ�ѧ����ʽ��д�����㡣


 ��ʦ����ɳ���ʱͬ��ѧ����ϵ�д�
��ʦ����ɳ���ʱͬ��ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
100��ʱ����1L���º��ݵ��ܱ������У�ͨ��0.1 mol N2O4��������Ӧ��N2O4(g)  2NO2(g);��H=" +57.0" kJ��mol-1��NO2��N2O4��Ũ����ͼ����ʾ��NO2��N2O4��������������Ũ�ȵĹ�ϵ����ͼ��ʾ��
2NO2(g);��H=" +57.0" kJ��mol-1��NO2��N2O4��Ũ����ͼ����ʾ��NO2��N2O4��������������Ũ�ȵĹ�ϵ����ͼ��ʾ��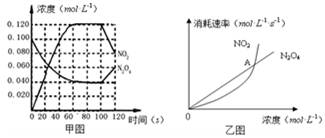
��1����0��60s�ڣ���N2O4��ʾ��ƽ����Ӧ����Ϊ mol��L-1��s-1��
��2�����ݼ�ͼ���й����ݣ�����100��ʱ�÷�Ӧ��ƽ�ⳣ��K1= =0.36mol.L-1.S-1
�������������䣬�����¶���120�棬�ﵽ��ƽ��ij�����k2����k1 k2�������������������������3����Ӧ���е�100sʱ������һ�����������仯���仯������������ ��
A�������¶� B��ͨ�뺤��ʹ��ѹǿ���� C�����������г���N2O4 D�������������
��4����ͼ��, ����A��ʾ�÷�Ӧ��������״̬Ϊ ��
A��ƽ��״̬ B��������Ӧ�����ƶ� C�����淴Ӧ�����ƶ� D�����ж�
��5����֪N2(g)+2O2(g)=2NO2(g) ��H=" +67.2" kJ��mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ��H=" -534.7" kJ��mol-1
N2O4(g)  2NO2(g) ��H=" +57.0" kJ��mol-1
2NO2(g) ��H=" +57.0" kJ��mol-1
��2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ��H= kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ĿǰΪֹ���ɻ�ѧ��ת��Ϊ���ܻ������Ȼ������ʹ������Ҫ����Դ��
��1����ѧ��Ӧ�зų������ܣ��ʱ䣬��H���뷴Ӧ���������ļ��ܣ�E���йء�
��֪��H2(g)��Cl2(g)��2HCl(g) ��H����185kJ/mol
E��H��H����436 kJ/mol��E��Cl��Cl����247 kJ/mol
��E��H��Cl���� ��
��2����֪��Fe2O3(s)��3CO(g)��2Fe(s)��3CO2(g) ��H����25kJ/mol
3 Fe2O3(s)��CO(g)��2Fe3O4(s)��CO2(g) ��H����47kJ/mol
Fe3O4(s)��CO(g)��3FeO(s)��CO2(g) ��H����19kJ/mol
��д��CO��ԭFeO���Ȼ�ѧ����ʽ�� ��
��������п�ѧ�������һ��ʹ�ù������ʵ�ȼ�ϵ�أ���Ч�ʸ��ߡ�һ���缫ͨ���������һ���缫ͨ���������������й��������Dz�����Y2O3��Y���ƣ���ZrO2��Zr��ﯣ� ���壬���ڸ������ܴ���O2-���ӣ�����������Ӧ������ȫ�����Զ��飨C4H10���������͡�
�ٵ�ص�������ӦʽΪ ____ ��
�ڷŵ�ʱ�����������O2-���ӵ��ƶ��������� ���ƶ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���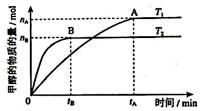
��ӦI�� CO(g)+2H2(g) CH3OH(g) ��H1
CH3OH(g) ��H1
��ӦII�� CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ��H2
CH3OH(g)+ H2O(g) ��H2
��������Ӧ���ϡ�ԭ�Ӿ��á�ԭ����� (�I����)��
���������������������£������¶ȶԷ�ӦII��Ӱ�죬ʵ������ͼ��ʾ
��ͼ�������ж� ��H2 0 (���������=������)��
��ij�¶��£���2 mol CO2��6 mol H2����2L���ܱ������У�������ӦII���ﵽƽ����c(CO2)= 0��2 mol/L�� ���ʱ�����е�ѹǿΪԭ���� ��
��2����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ��H =-1275��6 kJ/mol
�� 2CO (g)+ O2(g) = 2CO2(g) ��H =-566��0 kJ/mol
�� H2O(g) = H2O(l) ��H =-44��0 kJ/mol
�����1 mol�״�����ȫȼ������1 molһ����̼��Һ̬ˮ�ų�������Ϊ ��
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�ã�
�ٸõ�ظ����ĵ缫��ӦΪ
�ڴ˵�����ļ״�1��6��ʱ����Ӧ�е���ת����ĿΪ
�����Դ�ȼ�ϵ��ΪǦ���س�磬��Ӧ��ͼ���Ҳ�缫�������ص� (��������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ú��Ϊȼ�Ͽ�ͨ����������;����
;��I��C(s) +O2 (g) == CO2(g) ��H1<0 ��
;��II�����Ƴ�ˮú����C(s) +H2O(g) == CO(g)+H2(g) ��H2>0 ��
��ȼ��ˮú����2CO(g)+O2 (g) == 2CO2(g) ��H3<0 ��
2H2(g)+O2 (g) == 2H2O(g) ��H4<0 ��
��ش��������⣺
��1�� ;��I�ų������� ( ����ڡ������ڡ���С�ڡ�) ;��II�ų���������
��2�� ��H1����H2����H3����H4����ѧ��ϵʽ�� ��
��3��12g̿���������в���ȫȼ������һ����̼���ų�110��35kJ���������Ȼ�ѧ����ʽΪ ��
��4��ú̿��Ϊȼ�ϲ���;��II���ŵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪��������ͨ����������S8(б����)����ʽ���ڣ���������״̬ʱ������S2��S4��S6��S8�ȶ���ͬ�������壬����S4��S6��S8�������ƵĽṹ�ص㣬��ṹ����ͼ��ʾ��
��һ�������£�S8(s)��O2(g)������Ӧ����ת��ΪSO2(g)��SO3(g)����Ӧ���̺�������ϵ������ͼ��ʾ(ͼ�еĦ�H��ʾ����1 mol������������)��
(1)д����ʾS8ȼ���ȵ��Ȼ�ѧ����ʽ_____________________��
(2)д��SO3�ֽ�����SO2��O2���Ȼ�ѧ����ʽ_________________________��
(3)����֪SO2���������ļ���Ϊd kJ��mol-1��O2���������ļ���Ϊe kJ��mol-1����S8������������ļ���Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�о�NO2��SO2 ��CO�ȴ�����Ⱦ����IJ���������������Ҫ���塣
��1��I2O5��ʹH2S��CO��HC1�������������ڶ����ⶨCO�ĺ�������֪��
2I2(s)+5O2(g)��2I2O5(s) ��H����75.56 kJ��mol��1
2CO(g)+O2(g)��2CO2(g) ��H����566.0 kJ��mol��1
д��CO(g)��I2O5(s)��Ӧ����I2(s)��CO2(g)���Ȼ�ѧ����ʽ�� ��
��2��һ�������£�NO2��SO2��Ӧ����SO3��NO�������壺NO2(g)+SO2(g) SO3(g)+NO(g)�������Ϊ1��2��NO2��SO2���������ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��
SO3(g)+NO(g)�������Ϊ1��2��NO2��SO2���������ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��
a����ϵѹǿ���ֲ���
b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ���
d��ÿ����1molSO2��ͬʱ����1molNO
���������Ӧƽ��ʱNO2��SO2�����Ϊ1��6����ƽ�ⳣ��K�� ��
��3���������������������л�ȡ������̼���ö�����̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��CO2 (g)��3H2(g) CH3OH(g)��H2O(g) ��H3
CH3OH(g)��H2O(g) ��H3
��ȡ��ݵ������CO2��H2�ĵĻ������ �����ʵ���֮�Ⱦ�Ϊ1��3�����ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״������������(CH3OH) �뷴Ӧ�¶�T�Ĺ�ϵ������ͼ��ʾ��������CO2ת��Ϊ�״���Ӧ�ġ�H3 0�����������������������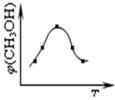
�����ݻ�Ϊ1L�ĺ����ܱ������г���1molCO2��3molH2������������Ӧ�����CO2��CH3OH(g)��Ũ����ʱ��仯������ͼ��ʾ����������ƽ����ϵ���ٳ�0.5molCO2��1.5molˮ�����������¶Ȳ��䣩�����ƽ�⽫ �ƶ����������Ӧ�������������淴Ӧ������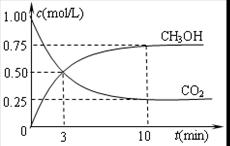
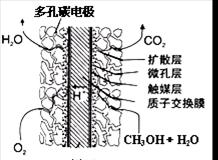
��ֱ�Ӽ״�ȼ�ϵ�ؽṹ������ͼ��ʾ���乤��ʱ�����缫��Ӧʽ�ɱ�ʾΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�á�������������������գ�
��1��ͬ��ͬѹ�£�H2(g)+Cl2(g)��2HCl(g)�����պ͵�ȼ�����Ħ�H����ѧ��������ͬ���ֱ�Ϊ��H1����H2����H1______��H2��
��2����ͬ�����£�2mol��ԭ�������е����� 1mol����������е�������
��3����֪����ʱ���ױȰ����ȶ����Ƚ����з�Ӧ�Ц�H�Ĵ�С����H1_____��H2��
��4P(���ף�s) +5O2(g)��2P2O5(s) ��H1����4P(���ף�s)+5O2(g)��2P2O5(s) ��H2��
��4����֪��101 kPaʱ��2C(s) +O2(g)��2CO(g) ��H����221kJ��mol��1����̼��ȼ������ֵ 110.5 kJ��mol��1��
��5����֪��ϡ��Һ�У�H��(aq)+OH�� (aq)��H2O(l) ��H����57.3kJ/mol����Ũ������ϡNaOH��Һ��Ӧ����1 molˮ���ų������� 57.3 kJ��
��6�����淴Ӧ��aA(��)+bB(��) cC(��)+dD(��)����H��Q������ͼ�ش�
cC(��)+dD(��)����H��Q������ͼ�ش�
P1 ______ P2���ڣ�a+b��______��c+d������t1��______ t2�档
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����仯�����ڹ�ũҵ������������������Ҫ���á���ش��������⣺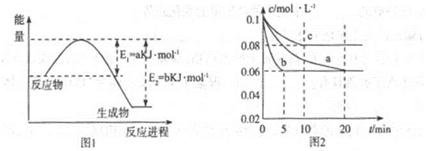
��1��ͼ1��1molNO2��1molCO��Ӧ����CO2��NO���������DZ仯ʾ��ͼ(a��b������0��)��֪:2CO(g)+2NO(g)=N2(g)+2CO2(g)��H=-ckJ��mol-1��c>0��
��д��CO��NO2��ԭ��N2ʱ���Ȼ�ѧ����ʽ____________��
��2��ͼ2��ʵ������������ͬ�������ܱ������кϳɰ�ʱ��N2��Ũ����ʱ��ı仯����(��a��b��c��ʾ������֪������������ʼ����Ũ�Ⱦ�Ϊ��c(N2)=0.1mol��L-1��c(H2)=0.3mol��L-1���ϳɰ��ķ�Ӧ��N2(g)+3H2(g) 2NH3(g)��H<0
2NH3(g)��H<0
�ټ�����a��ƽ��ʱH2��ת����Ϊ______��
����ͼ2��֪��b��c����һ��������a��ͬ����c�������ı������______��
��д���ж�b��a������ͬ������____________��
��3������ͼ2��c�����ºϳɰ����ݻ��̶�������֪��ѧƽ�ⳣ��K���¶�(T)�Ĺ�ϵ���±�:
����ȷ��K1����Դ�С��K1______4.1x106(��д��>����-����<����
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�����ݵ� ��______(�������ĸ����
A��������NH3��Ũ�ȱ��ֲ��� B��2v(N2)(����=v(H2)(�棩
C��������ѹǿ���ֲ��� D�����������ܶȱ��ֲ���
��4����NH4Cl��Һ�����Ե�ԭ����(�����ӷ�Ӧ����ʽ��ʾ )______��
��250Cʱ����pH=x��ˮ��pH=y������(��x+y=14,x>11)�������Ϻ�������Һ�и������ӵ�Ũ�ȹ�ϵ��ȷ����
A��[SO42-]>[NH4+]>[H+]>[OH-]
B��[NH4+]>[SO42-]>[OH-]>[H+]
C��[NH4+]+[H+]>[OH-]+[SO42-]
D��[NH4+]>[SO42-]>[H+]>[OH-]
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com