
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。某工厂对工业污泥中Cr(III)回收与再利用工艺流程如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
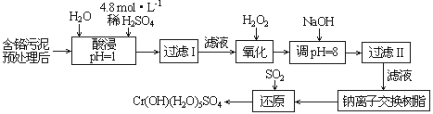
已知:常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH(开始沉淀的pH按金属阳离子浓度为1.0mol·L-1计算)和完全沉淀时溶液的pH,见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.5 | —— | —— | 4.7 | —— |
沉淀完全时的pH | 3.2 | 9.7 | 11.1 | 8 | 6.7 | 9(>9溶解) |
重铬酸根离子(Cr2O72-)在溶液中存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
(1)该工厂对工业污泥中Cr(+3价)回收与再利用工艺流程中,其中一步存在氢氧化铁的沉淀溶解平衡:Fe(OH)3(s)![]() Fe3+(aq)+3OH-(aq),其溶度积常数表达式为Ksp=__。
Fe3+(aq)+3OH-(aq),其溶度积常数表达式为Ksp=__。
(2)酸浸时,为了提高浸取率可采取的措施是__(至少答一点)。
(3)加入H2O2的作用是__。调节溶液的pH=8是为了除去__离子。
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的的杂质离子是__。
【答案】c(Fe3+)·c3(OH-) 升高温度、搅拌、增加浸取时间等(答出一点即可) 氧化Cr3+为Cr2O72-,以便于杂质离子分离 Fe3+和Al3+ Ca2+、Mg2+
【解析】
含铬污泥预处理后,水溶、酸溶、过滤得到滤液,向滤液中加入过氧化氢氧化铬离子变成+6价Cr,加入氢氧化钠溶液调节pH=8,Fe3+和Al3+转化为沉淀除去,再向滤液加入钠离子交换树脂后通入二氧化硫还原得到目标产物,结合题干综合分析即可解答问题。
(1) Fe(OH)3溶度积常数表达式为Ksp= c(Fe3+)·c3(OH-),故答案为:c(Fe3+)·c3(OH-);
(2)酸浸时,为了提高浸取率可采取的措施是:增加浸取时间、不断搅拌混合物、滤渣多次浸取等,因此正确答案是:升高反应温度、搅拌(或增加浸取时间、滤渣多次浸取等);
(3)双氧水有强氧化性,能氧化还原性的物质,Fe2+和Cr3+有还原性,Fe2+和Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离;硫酸浸取液中的金属离子主要是Cr3+ ,其次是Fe 3+、A13+、Ca2+和Mg2+,加入NaOH溶液使溶液呈碱性,溶液pH=8,Fe3+、Al3+转化为沉淀除去,故正确答案是:氧化Cr3+为Cr2O72-,以便于杂质离子分离;Fe3+和Al3+;
(4)钠离子交换树脂交换的离子是钙离子和镁离子,故正确答案是:Ca2+、Mg2+。


科目:高中化学 来源: 题型:
【题目】将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,组成甲、乙两个装置(如图)。下列说法不正确的是

A.甲为原电池,负极反应为Zn-2e-=Zn2+
B.甲为原电池,Fe电极上有气体放出
C.乙为电解池,阴极反应式为2H++2e-=H2↑
D.一段时间后,甲、乙两表面皿中溶液均有红色出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种性能非常优越的金属,21世纪将是钛的世纪。
(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Cr原子的核外电子排布式为____。
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为____
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是_____;
③NH4Cl中存在的作用力有_____,NH4Cl熔沸点高于CH3CH2OH的原因是_____,Ti(OCH2CH3)4分子中C原子的杂化形式均为 ____。
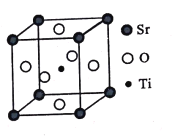
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于____位置;已知晶胞参数为a nm,Ti位于O所形成的正八面体的体心,则该八面体的边长为_____ m(列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有止血功效,存在于多种中药中,其结构简式如下图,下列说法不正确的是
![]()
A. 咖啡酸可以发生取代、加成、氧化、酯化、加聚反应
B. 1mol 咖啡酸最多能与5 mol H2反应
C. 咖啡酸分子中所有原子可能共面
D. 蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种一元醇A,则醇A 的分子式为C8H10O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在材料研发中取得了较大的进展,例如嫦娥四号探测器所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。再例如我国科学家发现了硒化铜纳米催化剂在二氧化碳电化学还原法生产甲醇过程中催化效率高。请回答下列问题:
(1)基态As原子的核外价电子排布图为_____。
(2)镓失去电子的逐级电离能(单位:kJmol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____和+3,砷的电负性比镓_____(填“大”或“小”)。
(3)硒所在的主族中,简单的气态氢化物沸点最低的是_____(填化学式)。
(4)电还原制备CH3OH的原理:2CO2+4H2O![]() 2CH3OH+3O2。在该反应中,含极性键的非极性分子是_____(填化学式)。
2CH3OH+3O2。在该反应中,含极性键的非极性分子是_____(填化学式)。
(5)苯分子中6个C原子,每个C原子有一个2p轨道参与形成大π键。6个2p轨道垂直平面形成稳定的大π键,符号为П![]() (右下角“6”表示6个原子,右上角“6”表示6个电子)。已知某化合物的结构简式为
(右下角“6”表示6个原子,右上角“6”表示6个电子)。已知某化合物的结构简式为![]() ,不能使溴水褪色,由此推知,该分子中大π键表示为_____。
,不能使溴水褪色,由此推知,该分子中大π键表示为_____。
(6)废旧印刷电路版中含有铜,为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶解铜,写出其离子方程式_____。
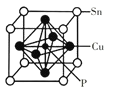
(7)磷青铜晶胞结构如图所示,它由Cu、Sn和P构成,锡原子位于立方体顶点,铜原子位于面心,P原子位于铜原子构成的正八面体的体心。则磷青铜的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 X、Y、Z、W 的原子序数依次增加。m、p、r 是由这些元素组成的二元化合物,n 是 W 的单质,q 是 Y 的单质,s 是 Z 的单质且常温下为淡黄色固体,m 与 r 相遇会产生白烟。上述物质的转化关系如图所示。下列说法不正确的是( )
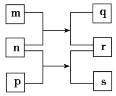
A.原子半径:Z>W>X
B.Y 的一种氢化物可作为火箭的燃料
C.Z 的氧化物对应的水化物酸性一定比 W 的弱
D.X、Y、W 三种元素组成的化合物可为离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)A元素次外层电子数是最外层电子数的![]() ,其外围电子轨道表示式是__。
,其外围电子轨道表示式是__。
(2)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是__,在元素周期表中的位置是__,位于周期表___区,写出基态B原子的核外电子排布式___。
(3)C、N、O、F四种元素第一电离能由大到小的顺序为___,电负性由大到小的顺序为___。
(4)基态Fe2+核外电子排布式为__,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为__。
(5)根据元素As在周期表中的位置预测As的氢化物分子的空间构型为__,其沸点比NH3的__(填“高”或“低”),其判断理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用pH传感器进行数字化实验,分别向两个盛50mL0.100mol/L盐酸的烧杯中匀速滴加50mL去离子水、50mL0.100mol/L 醋酸铵溶液,滴加过程进行磁力搅拌,测得溶液pH随时间变化如图所示。已知常温下醋酸铵溶液pH=7,下列说法错误的是
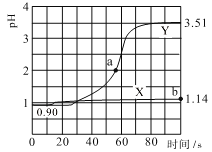
A.曲线X表示盐酸中加醋酸铵溶液稀释的pH变化
B.曲线Y的pH变化主要是因为CH3COO-与H+结合成了弱电解质
C.a点对应的溶液中c(Cl-)+c(CH3COO-)+c(CH3COOH)-c(NH4+)=0.01mol/L
D.b点对应的溶液中水电离的c(H+)=10-12.86 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com