
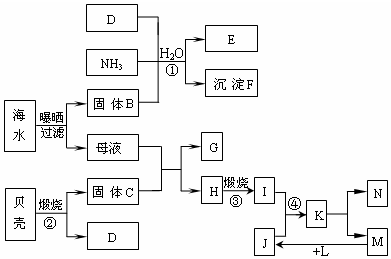
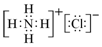 .
.分析 贝壳主要成分是碳酸钙,煅烧生成二氧化碳和氧化钙,所以C是CaO,D是CO2,海水暴晒得到固体B为NaCl,氯化钠、氨气和二氧化碳反应生成碳酸氢钠和氯化铵,所以E是NH4Cl、F是NaHCO3,母液和CaO反应生成H和G,H能煅烧,则H为Mg(OH)2,母液中主要成分是MgCl2,G为CaCl2,煅烧氢氧化镁得到固体I为MgO,N是一种常见金属单质,则N为Mg,电解熔融MgCl2得到Mg和Cl2,所以M是Cl2,氢气在氯气中燃烧得到HCl,盐酸和MgO反应得到MgCl2,所以L是H2、J是HCl,再结合题目分析解答.
解答 解:贝壳主要成分是碳酸钙,煅烧生成二氧化碳和氧化钙,所以C是CaO,D是CO2,还是暴晒得到固体B为NaCl,氯化钠、氨气和二氧化碳反应生成碳酸氢钠和氯化铵,所以E是NH4Cl、F是NaHCO3,母液和CaO反应生成H和G,H能煅烧,则H为Mg(OH)2,母液中主要成分是MgCl2,G为CaCl2,煅烧氢氧化镁得到固体I为MgO,N是一种常见金属单质,则N为Mg,电解熔融MgCl2得到Mg和Cl2,所以M是Cl2,氢气在氯气中燃烧得到HCl,盐酸和MgO反应得到MgCl2,所以L是H2、J是HCl,
(1)通过以上分析知,N为Mg,N的化学式为Mg,E的电子式为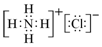 ,
,
故答案为:Mg;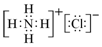 ;
;
(2)该反应为二氧化碳、氨气和氯化钠溶液的反应,生成氯化铵和碳酸氢钠,所以反应①的化学方程式为:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,
故答案为:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(3)反应④是氧化镁和盐酸反应生成氯化镁和水,反应的离子方程式为:MgO+2H+=H2O+Mg2+,
故答案为:MgO+2H+=H2O+Mg2+;
(4)K为氯化镁,氯化镁属于强酸弱碱盐,蒸发过程中镁离子水解生成氢氧化镁和HCl,且蒸发促进HCl挥发导致促进氯化镁水解,为抑制水解,MgCl2溶液必须在氯化氢气体中进行蒸发结晶制得MgCl2晶体,熔融后电解才能制取金属镁,
故答案为:MgCl2溶液必须在氯化氢气体中进行蒸发结晶制得MgCl2晶体,熔融后电解才能制取金属镁.
点评 本题以Ca、Na、Mg元素化合物为载体考查无机物推断,涉及联氨制碱法、金属的冶炼等知识点,根据物质的性质、反应条件等进行推断,注意(2)中通入气体先后顺序、(4)中获取Mg单质的方法等知识点,为易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
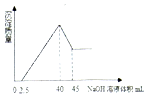 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )| A. | 1mol/L | B. | 2mol/L | C. | 3mol/L | D. | 4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 序号 | 起始温度t1/℃ | 终止温度 (t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 | |
| B. | 温度、压强一定时,吸热的熵增反应一定能够自发进行 | |
| C. | 反应焓变是决定反应能否自发进行的唯一因素 | |
| D. | 固体的溶解过程与熵变无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80mL10mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4 NA | |
| B. | 标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数为1.5 NA | |
| C. | 7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA | |
| D. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类数相同 | |
| B. | 乙烷、苯、裂化汽油溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | Na在Cl2中燃烧的生成物含离子键,所以NaCl固体可导电 | |
| D. | 乙醇的沸点比乙酸的沸点低,所以乙醇和乙酸可通过蒸馏初步分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢气 | 原煤 (主要成份是C) | 汽油 (主要成份C8H18) |
| 热量(kJ) | 285.8 | 250.9 | 4910 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com