
| A. | 4.6g 由NO2和N2O4组成的混合气体中含有的原子总数为0.3NA | |
| B. | 0.2 g D216O中含有的质子数,中子数,电子数均为0.1NA | |
| C. | 铁与足量稀硝酸反应时,生产0.1mol NO转移的电子数为0.3NA | |
| D. | 6.2克白磷分子(P4)中含P-P键为0.05NA |
分析 A、NO2和N2O4的最简式均为NO2;
B、求出D216O的物质的量,然后根据D216O中含有的质子数、电子数和中子数均为10个来分析;
C、铁和硝酸反应生成NO时,氮元素的价态由+5价变为+2价;
D、求出白磷的物质的量,然后根据1mol白磷中含6mol共价键来分析.
解答 解:A、NO2和N2O4的最简式均为NO2,故4.6g混合物中含有的NO2的物质的量为0.1mol,则含有0.3NA个原子,故A正确;
B、0.2gD216O的物质的量为0.01mol,而D216O中含有的质子数、电子数和中子数均为10个,故0.01molD216O中含有的质子、中子和电子数均为0.1NA个,故B正确;
C、铁和硝酸反应生成NO时,氮元素的价态由+5价变为+2价,故当生成0.1molNO时,转移的电子数为0.3NA个,故C正确;
D、由于白磷的分子式为P4,故6.2g白磷的物质的量为0.05mol,而1mol白磷中含6mol共价键,故0.05mol白磷中含0.3NA条共价键,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 23:28:9 | C. | 6:3:2 | D. | 28:23:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在电解冶炼铝的过程中加入冰晶石,可起到降低Al2O3熔点的作用.冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空:
在电解冶炼铝的过程中加入冰晶石,可起到降低Al2O3熔点的作用.冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素B的化合物可以用来做焰火材料 | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 工业上常用电解法制备元素C、D、E的单质 | |
| D. | 元素B、D的最高价氧化物对应的水化物之间可能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
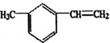 下列说法正确的是( )
下列说法正确的是( )| A. | 分子中所有碳原子可能处于同一平面上 | |
| B. | 分子中至少有7个碳原子一定处于同一平面上 | |
| C. | 分子中所有原子有可能处于同一平面上 | |
| D. | 分子中至多有16个原子处于同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物 | B. | 氧化物 | C. | 无机物 | D. | 钾盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NH${\;}_{4}^{+}$、Br-、I- | B. | Fe2+、H+、NO3-、Cl- | ||
| C. | Fe3+、H+、SO42-、Br- | D. | Fe3+、Ca2+、NO3-、SO42-、 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com