
| A、溶液的pH>7 |
| B、得到澄清透明的溶液 |
| C、得到浑浊液体 |
| D、先有沉淀生成后逐渐溶解 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
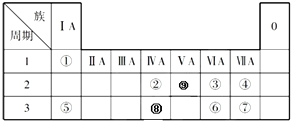
| A、①④⑤⑥ | B、③④⑤⑥ |
| C、只有①③ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、偏铝酸钠中通足量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| B、氯化铝溶液与足量氨水反应:Al3++4OH-═AlO2-+2H2O |
| C、氯化铝溶液与足量NaOH溶液反应:Al3++3OH-═Al(OH)3↓ |
| D、氧化铝和适量的烧碱溶液反应:Al2O3+2OH-═2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、互为同系物的有机物其组成元素相同,且结构必须相似 |
| B、分子组成相差一个或若干个CH2原子团的化合物一定互为同系物 |
| C、分子式为C3H6与C6H12的两种有机物一定互为同系物 |
| D、互为同系物的有机物其相对分子质量数值一定相差14n(n为正整数) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | ||||
| B、在AgCl沉淀中加入碘化钾溶液:AgCl(s)+I-(aq)═AgI (s)+Cl-(aq) | ||||
C、铜与浓硫酸共热:Cu+4H++SO42-
| ||||
D、电解氯化镁溶液:2Cl-+2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
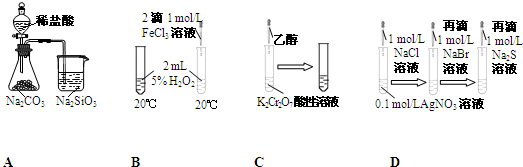
| 实验 | 现象 | 结论 |
| A | 锥形瓶中有气体产生,烧杯中液体变浑浊 | Cl、C、Si非金属性依次减弱 |
| B | 右边试管中冒出的气泡快 | FeCl3能加快H2O2分解速率 |
| C | 试管中橙色溶液变为绿色 | 乙醇发生消去反应生成乙烯 |
| D | 试管中溶液依次出现白色、淡黄色、黑色沉淀 | 溶解度:AgCl<AgBr<Ag2S |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由金属W制备的高效电池可用NH4Cl溶液作电解质 |
| B、元素X与氢形成的化合物中不可能既有极性健又有非极性健 |
| C、元素Y、Z分别形成的简单离子,后者的离子半径较前者大 |
| D、元素Y、Z的最高价氧化物对应的水化物之间不能反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com