
| A. | 稀释浓硫酸时,将浓硫酸慢慢注入盛有水的烧杯,并不断用玻璃棒搅拌 | |
| B. | 制取蒸馏水时,为防止烧瓶内产生暴沸现象,应先向烧瓶中加入几片碎瓷片 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 将铜丝用盐酸洗涤后,蘸取NaCl溶液,在酒精灯上灼烧观察焰色为黄色证明含有Na+ |
分析 A.浓硫酸密度大于水,且稀释过程中放出大量热,应该将浓硫酸加入水中;
B.蒸馏时易发生爆沸现象,需要加入碎瓷片防止爆沸;
C.为了避免污染试剂,分液时分液漏斗中下层液体从下口放出,上层液体从上口倒出;
D.铜丝在灼烧时呈现蓝色,应该用铁丝或铂丝做实验.
解答 解:A.由于稀释过程中放出大量热,且浓硫酸浓度比水大,则稀释浓硫酸时将浓硫酸慢慢注入盛有水的烧杯,并不断用玻璃棒搅拌,故A正确;
B.制取蒸馏水时易发生爆沸现象,为防止烧瓶内产生暴沸现象,应先向烧瓶中加入几片碎瓷片,故B正确;
C.分液操作时,为了避免污染试剂,分液漏斗中下层液体应该从下口放出,上层液体从上口倒出,故C正确;
D.由于铜元素的焰色反应呈现蓝色,干扰的钠离子的检验,应该将铁丝或铂丝用盐酸洗涤后,蘸取NaCl溶液,在酒精灯上灼烧观察焰色,为黄色证明含有Na+,故D错误;
故选D.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及浓硫酸稀释、蒸馏操作、分液、焰色反应等知识,明确化学实验基本操作方法为解答关键,试题培养了学生的分析能力及化学实验能力.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲(弱电解质):乙、丙、丁(一水合氨、水、硝酸钡) | |
| B. | 甲(腐蚀品):乙、丙、丁(浓硫酸、烧碱、硝酸) | |
| C. | 甲(碱性氧化物):乙、丙、丁(过氧化钠、氧化镁、氧化铁) | |
| D. | 甲(合成高分子材料):乙、丙、丁(光导纤维、涤纶、玻璃) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z至少有一种为稀有气体元素 | B. | X、Y、Z可以组成共价化合物 | ||
| C. | 简单阴离子还原性强弱为Y>Z>X | D. | 原子半径大小为Z>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
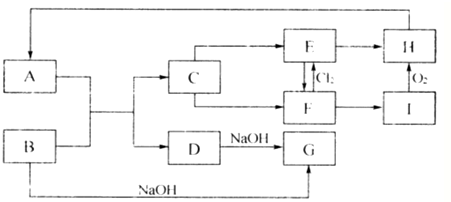
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com