
| A、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B、生铁比软铁心(几乎是纯铁)容易生锈 |
| C、铁制器件附有铜质配件,在接触处易生锈 |
| D、铁丝在纯氧气中燃烧 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),NH3和H2的物质的量(n)随时间变化关系如图所示,下列叙述正确的是( )
对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),NH3和H2的物质的量(n)随时间变化关系如图所示,下列叙述正确的是( )| A、点e的正反应速率比点d大 |
| B、点c处v(逆)>v(正) |
| C、点d(t1时刻)和点e(t2时刻)处N2物质的量相同 |
| D、图中字母标记的五点中a点对应的NH3的物质的量最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
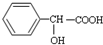 有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发生显色反应的同分异构体有多少种(不考虑立体异构)( )
有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发生显色反应的同分异构体有多少种(不考虑立体异构)( )| A、6 种 |
| B、9 种 |
| C、15 种 |
| D、19 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池(盐桥起到导电作用).下列判断不正确的是( )
控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池(盐桥起到导电作用).下列判断不正确的是( )| A、反应开始时,乙中石墨电极上发生氧化反应 |
| B、反应开始时,甲中石墨电极作负极 |
| C、电流计读数为零时,反应达到化学平衡状态 |
| D、电流计读数为零后,在甲中溶入FeCl2,电流表可能会再次产生偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n=2,H2O是氧化产物 |
| B、x=y=m=4 |
| C、该反应中R2+得到电子,被氧化为R3+ |
| D、任何氧化还原反应中氧化剂失电子总数都等于还原剂得电子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(HA) |
| A、②④⑥ | B、①③⑥⑦ |
| C、②④⑥⑦ | D、①②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
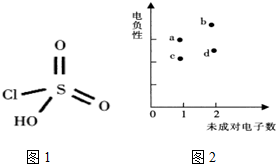 纯钛烤瓷牙是近几年才发展成熟的金属烤瓷技术,过氧硫酸被用于假牙的消毒.过氧硫酸可由氯磺酸通过反应I制得,氯磺酸结构如图1.
纯钛烤瓷牙是近几年才发展成熟的金属烤瓷技术,过氧硫酸被用于假牙的消毒.过氧硫酸可由氯磺酸通过反应I制得,氯磺酸结构如图1.查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知在一定条件下的反应4HCl+O2=2Cl2+2H2O中,有4mol HCl被氧化时,放出
(1)已知在一定条件下的反应4HCl+O2=2Cl2+2H2O中,有4mol HCl被氧化时,放出| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ?mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:
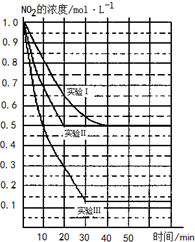 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为1.0mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.请回答下列问题:
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为1.0mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com