
���� ��1��ʵ��һ��ȷ��OH-���������ݵ���غ��ȷ��Cl-������ʵ���û�б�Ҫ��������ʵ�������ʵ��һû�б�Ҫ����
��2��ȡʵ��һϡ�ͺ����Һ50mL�����м���������AgNO3��Һ�ó���12.915g�������������غ�õ����������ʵ�����
��3��ʵ��һ��n��Mg2+��=$\frac{80.00g��15.00%}{24g/mol}$=0.5mol��n��HNO3��=0.1L��1.50mol/L=0.15mol��500mL��Һ��n��H+��=0.1mol/L��0.5L=0.05mol����ɼ���n ��OH-�������ݵ���غ�ɼ���n��Cl-�������������غ�ɼ���n��H2O�������ȷ����ѧʽ��
��� �⣺��1��ʵ��һ��ȷ��OH-���������ݵ���غ��ȷ��Cl-������ʵ���û�б�Ҫ��������ʵ�������ʵ��һû�б�Ҫ������ΪMg2+������֪��ֻҪOH-��Cl-ȷ��һ������һ�����õ���غ�Ϳ�ȷ����
�ʴ�Ϊ��û�б�Ҫ����ΪMg2+������֪��ֻҪOH-��Cl-ȷ��һ������һ�����õ���غ�Ϳ�ȷ����
��2���������غ����õ���n ��Cl-��=$\frac{12.915g}{143��5g/mol}$��$\frac{500ml}{50ml}$=0.9mol��
�ʴ�Ϊ��0.9mol��
��3��n��Mg2+��=$\frac{80.00g��15.00%}{24g/mol}$=0.5mol��n��HCl��=0.1L��1.50mol/L=0.15mol��500mL��Һ��n��H+��=0.1mol/L��0.5L=0.05mol��n ��OH-��=n��HCl��-n��H+��=0.15mol-0.05mol=0.1mol��
�ɵ���غ��֪2n��Mg2+��=n ��OH-��+n ��Cl-������n ��Cl-��=2��0.5mol-0.1mol=0.9mol��
n ��H2O��=$\frac{49.25g-0.5mol��24g/mol-0.1mol��17g/mol-0.9mol��35.5g/mol}{18g/mol}$=0.2mol
��n��Mg2+����n ��OH-����n ��Cl-����n ��H2O��=0.5��0.1��0.9��0.2=5��1��9��2
����ѧʽΪ��Mg5��OH��Cl9•2H2O��
�ʴ�Ϊ��Mg5��OH��Cl9•2H2O��
���� ���⿼�����ʵ���ɵIJⶨ���ۺϿ���ѧ�����������ͼ��������Լ�ʵ������������ע����������غ�����⣬��Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaOH��Ħ��������40g/mol | |
| B�� | 1mol H2��������������Է���������� | |
| C�� | 1mol H2O�ڱ�״���µ����ԼΪ22.4L | |
| D�� | ������Ħ����������ֵ�ϵ���������Է������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��

| A�� | �ù������м��Լ��Ķ��Ѻ��γ� | B�� | �ù����е�X��Y��Ϊ����� | ||
| C�� | �������������X��Y���ӵ����� | D�� | �ù��̲�������������Ⱦ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
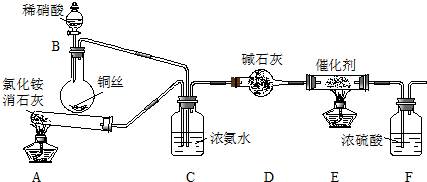

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
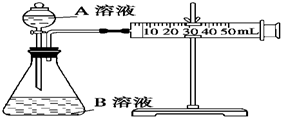 �ס��ҡ�������ʵ��С������KMnO4������Һ��H2C2O4��Һ��Ӧ�о�Ӱ�췴Ӧ���ʵ����أ����ʵ�鷽�����£�ʵ��������KMnO4��Һ���Ѽ���H2SO4����
�ס��ҡ�������ʵ��С������KMnO4������Һ��H2C2O4��Һ��Ӧ�о�Ӱ�췴Ӧ���ʵ����أ����ʵ�鷽�����£�ʵ��������KMnO4��Һ���Ѽ���H2SO4����| ��� | A��Һ | B��Һ |
| �� | 2mL0.1mol/LH2C2O4��Һ | 4mL 0.01mol/L KMnO4��Һ |
| �� | 2mL0.2mol/LH2C2O4��Һ | 4mL 0.01mol/L KMnO4��Һ |
| ��� | ��Һ | ���� |
| �� | 2mL 0.1mol/L H2C2O4��8mL 0.1mol/L KMnO4 | ��ˮ |
| �� | 2mL 0.1mol/L H2C2O4��8mL 0.1mol/L KMnO4 | ��ˮ |
| ʱ�䣨min�� | 0-4 | 4-8 | 8-12 | 12-16 | 16-21 | 21-22 | 22-23 |
| c��KMnO4����10-4mol/L�� | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 |
| �ԣ�KMnO4����10-4mol/��L•min�� | a | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������ʶ�������̬�� | |
| B�� | ��Ȳ��̼������������С | |
| C�� | ��ˮ������ϩ����Ȳ�ӳɣ������������鷴Ӧ | |
| D�� | һ�������У����õ��Ӷ��������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 17g����������������Ϊ10NA | |
| B�� | 2.4g����þ���þ����ʱʧȥ������Ϊ0.1NA | |
| C�� | �ڱ�״���£�22.4L��������������ԭ����ΪNA | |
| D�� | ��25�桢ѹǿΪ1.01��105Paʱ��28g���������ķ�����ΪNA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com