
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
分析 (1)Mg(OH)2的饱和溶液中的溶度积计算饱和溶液中的氢氧根离子浓度,结合水溶液中离子积计算氢离子浓度计算pH,然后结合表中数据判断溶液所呈现的颜色;
(2)①反应前,n(Ag+)=0.018 mol•L-1×0.05 L=0.9×10-3 mol,n(Cl-)=0.020 mol•L-1×0.05 L=1×10-3 mol,反应后剩余的Cl-为0.1×10-3 mol,则混合溶液中,c(Cl-)=1.0×10-3 mol•L-1,c(Ag+)依据Ksp(AgCl)计算得到;
②根据溶液pH=-lgc(H+)及(2)计算;
③再计算混合后溶液,不发生反应时c(Ag+)、c(Cl-),计算离子浓度积,与溶度积比较,判断是否产生沉淀;
(3)根据硫化亚铁的溶度积常数和亚铁离子浓度计算硫离子浓度,再根据氢硫酸的电离平衡常数计算氢离子浓度.
解答 解:(1)25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12,根据反应Mg(OH)2(s)?Mg2++2OH-可得:c(Mg2+)c2(OH-)=5.6×10-12,
设c(OH-)=2c(Mg2+)=x,则:0.5x×x2=5.6×10-12,
解得:x=2.24×10-4mol/L,
c(H+)=$\frac{1{0}^{-14}}{2.24×1{0}^{-4}}$mol/L=4.5×10-11mol/L,
溶液的pH=10.4>9.6,所以溶液呈蓝色,
故答案为:蓝色;
(2))①反应前,n(Ag+)=0.018 mol•L-1×0.05 L=0.9×10-3 mol,n(Cl-)=0.020 mol•L-1×0.05 L=1×10-3 mol;反应后剩余的Cl-为0.1×10-3 mol,则混合溶液中,c(Cl-)=1.0×10-3 mol•L-1,c(Ag+)=Ksp(AgCl)/c(Cl-)=1.0×10-7 mol•L-1,
故答案为:1.0×10-7 mol•L-1;
②H+没有参与反应,完全沉淀后,c(H+)=0.010 mol•L-1,溶液的pH=-lg0.01=2,
故答案为:2;
②再向反应后的溶液中加入50mL0.001mol•L-1盐酸,不发生反应时c(Ag+)=$\frac{2}{3}$×1.8×10-7mol•L-1=1.2×10-7mol•L-1、c(Cl-)=$\frac{2}{3}$×[(0.001+1.8×10-7+0.001]mol•L-1≈0.001mol•L-1,而离子浓度积=0.001×1.2×10-7=1.2×10-10<1.8×10-10,所以没有沉淀产生,
故答案为:否;
(3)溶液中c(S2-)=$\frac{{K}_{sp}(FeS)}{c(F{e}^{2+})}$=$\frac{6.25×1{0}^{-18}}{1}$=6.25×10-18mol/L,c2(H+)•c(S2-)=1.0×10-22,则c(H+)=$\sqrt{\frac{1×1{0}^{-22}}{6.25×1{0}^{-18}}}$mol/L=4×10-3mol/L,
故答案为:4×10-3mol/L.
点评 本题考查了难溶物溶解平衡及其计算,题目难度中等,明确溶度积的含义及表达式为解答关键,注意掌握难溶物溶解平衡及沉淀转化的本质,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 等浓度CH3COOH溶液与NH3•H2O溶液等体积混合后,存在c(NH4+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 等浓度的HCl溶液与CH3COOH溶液中c(H+)也相同 | |
| C. | 向20mLHCl溶液中加入10mL同一浓度的HCl溶液时,其pH会改变 | |
| D. | 等浓度的CH3COOH溶液和NaOH溶液等体积混合后,溶液显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BeCl2溶液pH<7,将其蒸干、灼烧后可得残留物BeCl2 | |
| B. | BeCl2水溶液的导电性强,BeCl2一定是离子晶体 | |
| C. | Be(OH)2能溶于盐酸,不能溶于NaOH溶液 | |
| D. | Na2BeO2溶液pH>7,将其蒸干、灼烧后可得残留物Na2BeO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、C的氧化物均含离子键 | |
| B. | C离子的半径小于D离子的半径 | |
| C. | A、B可形成多种原子个数比为1:1的化合物 | |
| D. | 含D元素的盐溶液只能显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向试液中滴加氯化钡溶液,产生白色沉淀,则溶液中一定含有CO32- | |
| B. | 向试液中滴加浓氢氧化钠溶液,加热产生刺激性气味的气体,则溶液中一定含有NH4+ | |
| C. | 向试液中滴加硝酸银溶液,产生白色沉淀,则溶液中一定含有Cl- | |
| D. | 向试液中滴加盐酸,产生的气体能使品红溶液褪色,则溶液中一定含有SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温下SiO2(s)+2C(s)=Si(s)+2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 常温下,NH4Cl溶液加水稀释$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{{H}_{4}}^{+})}$不变 | |
| C. | 向硅酸钠溶液中滴加酚酞,溶液变红,证明了Na2SiO3发生了水解 | |
| D. | 如图可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化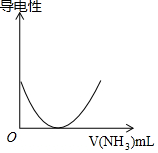 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体SiO2一定是晶体 | |
| B. | 晶体有固定的组成,非晶体没有固定的组成 | |
| C. | 晶体内部的微粒按一定规律呈周期性有序排列 | |
| D. | 晶体的基本结构单元(晶胞)全部是平行六面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作及现象 | 实验目的 | |
| A | 将SO2通入品红溶液中,品红溶液褪色;加热褪色后的品红溶液,溶液恢复红色 | 证明亚硫酸的不稳定性 |
| B | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生 | 证明常温下KSP(BaCO3)>KSP(BaSO4) |
| C | 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
| D | 将浓硫酸和碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
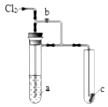 将氯气通入如图装置.若打开活塞,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,c很快褪色.则a溶液可能是( )
将氯气通入如图装置.若打开活塞,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,c很快褪色.则a溶液可能是( )| A. | 浓FeCl2溶液 | B. | 饱和KI溶液 | C. | 饱和食盐水 | D. | 浓NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com