
【题目】利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)。不同温度下,向装有足量的I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2 的体积分数ψ(CO2)随时间t变化曲线如右图,下列说法正确的是
5CO2(g)+I2(s)。不同温度下,向装有足量的I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2 的体积分数ψ(CO2)随时间t变化曲线如右图,下列说法正确的是

A. b点时,CO的转化率为20%
B. 容器内的压强保持恒定,表明反应达到平衡状态
C. b点和d点的化学平衡常数:Kb>Kd
D. 0到0.5min反应速率v(CO)=0.3mol·L-1·min-1
【答案】C
【解析】试题分析:A.5CO(g) +I2O5(s)![]() 5CO2(g)+I2(s)
5CO2(g)+I2(s)
起始量/mol 2 0
转化量/mol y y
b点量/mol 2-y y
根据b点时CO2的体积分数φ(CO2)=y÷2=0.80,得y=1.6mol,转化率等于=(变化量÷起始量)×100%=(1.6÷2)×100%=80%,A错误;B.两边计量数相等,所以压强始终不变,不能做平衡状态的标志,B错误;C.b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,C正确;D.0到0.5min时:5CO(g) +I2O5(s)![]() 5CO2(g)+I2(s)
5CO2(g)+I2(s)
起始量/mol 2 0
转化量/mol x x
a点量/mol 2-x x
根据a点时CO2的体积分数φ(CO2)=x÷2=0.30,得x=0.6mol;则从反应开始至a点时的反应速率为v(CO)=(0.6mol÷2L)÷0.5min=0.6 mol·L-1·min-1,D错误。答案选C。


科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
A、B、C、D、E是前四周期原子序数依次增大的五种元素。A元素原子的核外电子等于其电子层数;B元素基态原子有三个能级电子数相同;A和D可形成两种常见液态化合物甲、乙,其原子数之比分别为1:1,2:1;E元素原子的K、L层电子数之和等于其M、N层电子数之和。回答下列问题(涉及元素用相应化学符号表示):
(1)B、C、D三种元素中电负性最大的元素其基态原子的电子排布式为 。
(2)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。在B的基态原子中,核外存在 对自旋相反的电子。
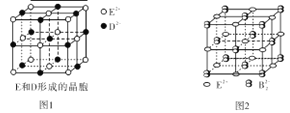
(3)由E和D形成的晶胞如图1所示,晶体中E2+周围等距且最近的E2+有 个;ED的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,焰色反应的原理是 。E和B可形成的晶体的晶胞结构与NaCl晶体的相似(如图2所示),但该晶体中含有的哑铃形B22-的存在,使晶胞沿一个方向拉长。晶体中E2+的配位数为_______________;该化合物的化学式为 。
(4)用高能射线照射液态化合物乙时,一个乙分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若干乙分子形成的“网”捕获,乙分子间能形成“网”的原因是 。
②由乙分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
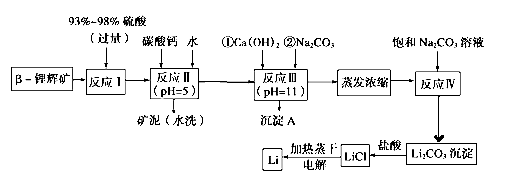
【题目】锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
已知:
①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:_______________________
(2)反应Ⅱ加入碳酸钙的作用是____________________
(3)写出反应Ⅲ中生成沉淀A的离子方程式:____________________
(4)洗涤所得Li2CO3沉淀要使用“热水”还是“冷水”理由是____________________
(5)流程中两次使用了Na2CO3溶液,第一次浓度小,第二次浓度大的原因是____________________
(6)该工艺中,电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图Z99所示电解槽。用氯碱工业中的离子交换技术原理,可电解Na2SO4溶液生产NaOH和H2SO4溶液。

下列说法正确的是( )
A.阳极反应式为2H++2e-===H2↑
B.从A口出来的是H2SO4溶液
C.a是阳离子交换膜,允许H+通过
D.Na2SO4溶液从E口加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关油脂的叙述中,错误的是
A.油脂分子结构中三个烃基一定相同
B.可以用纯碱溶液去除油污
C.可以用纯碱区别植物油和柴油
D.工业上可用油脂制造高级脂肪酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
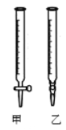
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号) 。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入______中。(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:______(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,未用待测液润洗
D.用酸式滴定管量取液体时,释放液体前滴定管前端有气泡,之后消失
(4)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视 。判断到达滴定终点的现象是:锥形瓶中溶液 。
(5)以下是实验数据记录表
滴定次数 | 盐酸体积mL | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 21.30 |
2 | 20.00 | 0.00 | 16.30 |
3 | 20.00 | 0.00 | 16.32 |
通过计算可得,该盐酸浓度为:______ molL-1(计算结果保留4位小数)
II、利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤1:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤2:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤:1相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
则BaCl2溶液浓度为______________________ mol·L-1。若步骤2中滴加盐酸时有少量待测液溅出,则Ba2+浓度的测量值将___________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
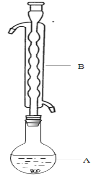
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。
④滤液在经过 、 后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________。其作用是___________。加入的硫粉用乙醇润湿的目的是 。
(2)步骤④应采取的操作是 、 。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。如果滤液中该杂质的含量不很低,其检测的方法是: 。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用 (填“酸式”或“碱式”)滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
第一次 | 0.30 | 31.12 |
第二次 | 0.36 | 31.56 |
第三次 | 1.10 | 31.88 |
则所得产品的纯度为 ,你认为影响纯度的主要原因是(不考虑操作引起误差) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com