
对H2O的电离平衡不产生影响的微粒是
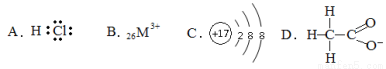
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源:2014-2015学年北京市石景山区高三一模理综化学试卷(解析版) 题型:实验题
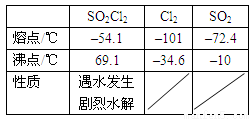
(15分)某学习小组依据反应:SO2(g)+ Cl2(g) SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如下图,有关信息如下表所示。
SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如下图,有关信息如下表所示。
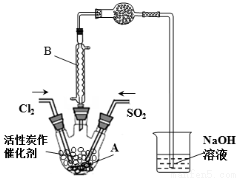
(1)若用浓盐酸与二氧化锰为原料制取Cl2,反应的化学方程式为___________。
(2)B仪器的作用是________________。
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择_____。
a.冰水浴 b.常温 c.加热至69.1℃
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为_____________。
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应。充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收。分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W。
①经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式___________。
②无色溶液W中的阴离子除含少量OH-外,还含有其它两种阴离子,检验溶液W中这两种阴离子方法是_______________________________________________。
③反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为Xg、Yg。
(6)计算SO2+ Cl2 SO2Cl2反应中,SO2的转化率____________(用含X、Y的代数式表示)。
SO2Cl2反应中,SO2的转化率____________(用含X、Y的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期第一次月考理综化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.汽油、柴油和植物油都属于烃
B.乙烯和苯加入溴水中,都能观察到褪色现象,原因是都发生了加成反应
C.乙醇既能被氧化为乙醛也能被氧化为乙酸
D.淀粉和纤维素互为同分异构体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广西玉林市博白县高三下学期返校调研考试化学试卷(解析版) 题型:填空题
(14分)已知:CH3COOH CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=
CH3COO-+H+达到电离平衡时,电离平衡常数可以表示为Ka=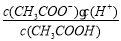 ;CH3COO-+H2O
;CH3COO-+H2O CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=
CH3COOH+OH-达到水解平衡时,水解平衡常数可以表示为Kh=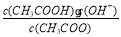 (式中各粒子浓度均为平衡时浓度)。
(式中各粒子浓度均为平衡时浓度)。
(1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解常数Kh以及水的离子积常数Kw的关系是_______________,由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度____________。如在25 ℃时碳酸的K1 草酸的K1(填“大于”、“等于”或“小于”),所以,在相同条件下,碳酸氢钠的溶液显 性,而草酸氢钠溶液显酸性。
(2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c mol·L-1的CH3COOH溶液中c(H+)=_________(不为0)。
(3)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;②______________;③用____________(填一种实验方法)测定溶液浓度c′。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广西玉林市博白县高三下学期返校调研考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞呈无色的溶液中:K+、Al3+、Cl-、CO32 -
B.澄清的溶液中:Na+、K+、MnO4—、AlO2—
C. =10-13 mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3-
=10-13 mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3-
D.c(I-)=0.1 mol·L-1的溶液中:Na+、H+、ClO-、SO42 -
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省湛江市高三高考测试(一)理综化学试卷(解析版) 题型:填空题
(16分)制备氢气可利用碘硫热化学循环法,其原理示意图如下。

(1)已知:①2SO3(g) 2SO2 (g) + O2 (g) △H1
2SO2 (g) + O2 (g) △H1
②H2SO4(l) SO3(g) + H2O(l) △H2
SO3(g) + H2O(l) △H2
2H2SO4(l) 2SO2 (g) + O2(g) +2H2O(l) △H3
2SO2 (g) + O2(g) +2H2O(l) △H3
则△H3= (用△H1和△H2表示)
(2)上述热化学循环制氢要消耗大量的能量,从绿色化学角度,能量供应的方案是 。
(3)碘化氢热分解反应为:2HI(g) H2(g)+I2(g) △H>0。则该反应平衡常数表达式:K= ;升温时平衡常数K (选填“增大”或“减小”)
H2(g)+I2(g) △H>0。则该反应平衡常数表达式:K= ;升温时平衡常数K (选填“增大”或“减小”)
(4)本生(Bunsen)反应中SO2和I2及H2O发生反应为:
SO2+I2+2H2O=3H++HSO4─+2I─;I─+I2 I3─。
I3─。
①当起始时,SO2为1mol,水为16mol,溶液中各离子变化关系如下图,图中a、b分别表示的离子是 、 。

②在水相中进行本生反应必须使水和碘显著过量,但易引起副反应将反应器堵塞。写出浓硫酸与HI发生反应生成硫和碘的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省湛江市高三高考测试(一)理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.22.4 L CH4中含有4 NA个C-H键
B.44g CO2含有2NA个氧原子
C.25 ℃,pH=1的硫酸溶液中含有的H+离子数为0.1NA
D.5.6g Fe与足量稀硝酸反应,转移的电子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省、广雅中学、佛山一中高三联考理综化学试卷(解析版) 题型:填空题
(16分)I.一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g) △H>0。1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H>0。1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
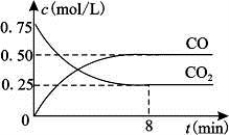
(1)8分钟内,CO的平均反应速率v(CO)=___________(结果保留3位有效数字)。
(2)1100℃时该反应的平衡常数K= (填数值);该温度下,若在8分钟时CO2和CO各增加0.5mol/L,此时平衡 移动(填“正向”、“逆向”或“不”)。
(3)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 3molFe、2molCO2 | 4molFeO、3molCO |
CO的浓度(mol/L) | C1 | C2 |
CO2的体积分数 | φ 1 | φ 2 |
体系压强(Pa) | P1 | P2 |
下列说法正确的是___________(填序号);
A.2C1 = 3C2 B.φ1 = φ2 C.P1<P2
II.(4)已知:①Fe(OH)3(aq) Fe3+(aq)+3OH-(aq);ΔH= a kJmol-1
Fe3+(aq)+3OH-(aq);ΔH= a kJmol-1
②H2O(l) H+(aq)+OH-(aq);ΔH=b kJmol-1
H+(aq)+OH-(aq);ΔH=b kJmol-1
请写出Fe3+发生水解反应的热化学方程式: 。
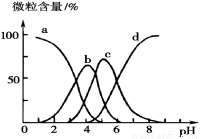
(5)柠檬酸(用H3R表示)可用作酸洗剂,除去水垢中的氧化铁。
溶液中H3R、H2R-、HR2--、R3-的微粒数百分含量与pH的关系如图所示。图中a曲线所代表的微粒数的百分含量随溶液pH的改变而变化的原因是 (结合必要的方程式解释)。调节柠檬酸溶液的pH=4时,溶液中上述4种微粒含量最多的是 (填微粒符号)。
III.(6)高铁酸钠(Na2FeO4)广泛应用于净水、电池工业等领域,工业常用电解法制备,其原理为
Fe+2OH--+2H2O FeO42--+3H2↑
FeO42--+3H2↑
请设计一个电解池并在答题卡的方框内画出该装置的示意图并作相应标注。

其阳极反应式为:________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三下学期一模考试理综化学试卷(解析版) 题型:推断题
选做【化学——有机化学】(12分)1-对甲苯基-3-苯基-2-丙烯-1-酮(以下用M表示)是一种常见的工业原料,其结构简式为: ,工业上合成M线路如下(反应中生成的小分子已略去):
,工业上合成M线路如下(反应中生成的小分子已略去):
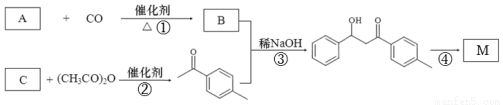
已知:在稀碱作用下,两分子的醛或酮可以互相作用,其中一个醛(或酮)分子中的α-氢加到另一个醛(或酮)分子的羰基氧原子上,其余部分加到羰基碳原子上,生成一分子β-羟基醛或一分子β-羟基酮。
请回答下列问题:
(1)有机物B的名称为 。
(2)物质A、C的关系为 。
a.同系物 b.同分异构体
c.同素异形体 d.分子式相差1个CH2
(3)①~④反应中,属于加成反应的有 。
(4)反应②的化学方程式为 。
(5) 的同分异构体有许多。能与NaHCO3反应,且含有联苯基(
的同分异构体有许多。能与NaHCO3反应,且含有联苯基(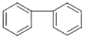 上1个氢原子被取代)的同分异构体共有 种。
上1个氢原子被取代)的同分异构体共有 种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com