
| 3.36L |
| 22.4L/mol |
|
| 0.3mol |
| 0.25L |
| 1 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、NA个Fe(OH)3胶体粒子的质量为107g |
| B、常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA |
| C、0.012kg(金刚石)中含有c-c键数目为2NA |
| D、常温常压下,1.7g H2O2中含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、360mg |
| B、3.6g |
| C、0.36g |
| D、2.5×10-4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
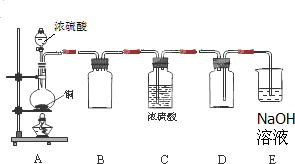 Na2SO3、SO2是中学常见的物质.
Na2SO3、SO2是中学常见的物质.| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 在试管A中加入少量待测液,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色. | |
| 步骤② | 在试管B中加入少量待测液, |
有白色沉淀生成, 证明待测液中含SO42-. |
| 步骤③ | 在试管C中加入少量待测液,滴加2mol/LHCl至溶液呈酸性,加入几滴 |
证明待测液中含SO32-. |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | Fe2+、NO3-、NH4+ | NaHSO4溶液 | 3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O |
| B | Ca2+、HCO3-、Cl- | 少量NaOH 溶液 | Ca2++2HCO3-+2OH-═2H2O+CaCO3↓+CO32- |
| C | K+、AlO2-、HCO3- | 通入少量CO2 | 2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- |
| D | NH4+、Al3+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH═BaSO4↓+2NH3?H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com