
【题目】以淀粉和油脂为原料,制备生活中某些物质。请回答:

(1)D中含有官能团的名称是________。
(2)反应④的有机反应类型是________。
(3)写出E可能的结构简式________。
(4)下列说法不正确的是______________ 。
A. 1mol D最多可以和3mol金属Na反应,生成标准状况下33.6L氢气
B. 葡萄糖、B以及淀粉这三者均能发生银镜反应
C. 反应①和反应②的反应类型相同
D. A和D有相同的官能团,两者属于同系物
【答案】羟基 皂化反应(取代或水解均可) CH3COOCH2CH(OH)CH2OH和CH3COOCH(CH2OH)2 B,C,D
【解析】
淀粉水解生成葡萄糖,葡萄糖的分子式为C6H12O6,葡萄糖在酒化酶的作用下转化成A,则A为CH3CH2OH,乙醇经连续氧化得到B、C,则B为CH3CHO、C为CH3COOH;C与D反应生成E,根据D、E的分子式可以知道,D为![]() 、E为
、E为
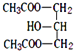 或
或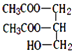 ,油脂甲在酸性条件下水解(取代)生成D、F,根据甲的化学式可以知道,F为C17H35COOH,
,油脂甲在酸性条件下水解(取代)生成D、F,根据甲的化学式可以知道,F为C17H35COOH,
(1)D中含有官能团的名称是:羟基。
(2)反应④的有机反应类型是:皂化反应(取代或水解均可)。
(3)E可能的结构简式:CH3COOCH2CH(OH)CH2OH或CH3COOCH(CH2OH)2
(4)A. 1mol D中有3mol羟基,最多可以和3mol金属Na反应,生成标准状况下33.6L氢气,故A正确;
B. 淀粉中没有醛基,不能发生银镜反应,故B错误;
C. 反应①为水解反应,反应②为分解反应,二者反应类型不同,故C错误;
D. A和D有相同的官能团,但是官能团个数不同,两者不属于同系物,故D错误;
故答案选BCD。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】白藜芦醇(结构简式: )属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用。某课题组提出了如下合成路线:
)属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用。某课题组提出了如下合成路线:

已知:①RCH2Br +![]()
②
根据以上信息回答下列问题:
(1)白藜芦醇的分子式是_________
(2)C→D的反应类型是:__________;E→F的反应类型是______。
(3)化合物A不与FeCl3溶液发生显色反应,能与NaHCO3溶液反应放出CO2,推测其核磁共振谱(1H-NMR)中显示不同化学环境的氢原子个数比为_______(从小到大)。
(4)写出A→B反应的化学方程式:_____________;
(5)写出结构简式;D________、E___________;
(6)化合物![]() 符合下列条件的所有同分异构体共________种,
符合下列条件的所有同分异构体共________种,
①能发生银镜反应;②含苯环且苯环上只有两种不同化学环境的氢原子。
写出其中不与碱反应的同分异构体的结构简式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,
![]()
第3周期中Z元素的简单离子半径最小。下列说法正确的是( )
A.Z位于第3周期ⅠA族 B.X、Y、Z、W、Q这五种元素的最高正价均等于其所在族的族序数
C.X的最高价氧化物对应的水化物和X的氢化物形成的化合物属于共价化合物 D.Y元素气态氢化物比W元素的气态氢化物更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3 , 还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
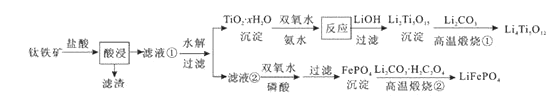
下列说法不正确的是( )
A.“酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C.“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O↑+3CO2↑
2LiFePO4+H2O↑+3CO2↑
D.TiO2 · xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/ ℃ | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | 88 |
可知,40 oC前,未达到平衡状态,随着温度升高,转化率变大;40 oC后,H2O2分解加剧,转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_______(填“酸性”,“中性”或“碱性”),溶液中c(Na+) _______c(CH3COO-)(填“ >” 或 “=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈_______(填“酸性”,“中性”或“碱性”),溶液中c(Na+)_______c(CH3COO-) (填“ >” 或“=”或“<”)。
(3)酸碱中和反应是_______反应 ,盐类水解是_______反应,(填吸热,放热)。盐类水解的本质是_______水的电离,(填促进,抑制)。升高温度_______盐类的水解。(填促进,抑制)
(4)弱电解质的电离常数只受_______影响,升温电离常数_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究化合物A(仅含三种元素,摩尔质量为198g/mol)的组成与性质,设计并完成以下实验:取3.96g化合物A溶于水中,一段时间后全部转化为B(红褐色沉淀)、C(一种碱)和气体单质D(可使带火星的木条复燃),向溶液中加入100mL 0.6mol/L稀硫酸,再加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将沉淀洗涤后充分灼烧,得到红棕色固体粉末1.60g;将所得溶液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A所含有的元素为________;化合物A与H2O反应的离子方程式为:________。
(2)化合物A可由FeCl3和KClO在强碱性条件下制得,其反应的离子方程式为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程。下列有关说法正确的是

A. 制取NaHCO3的反应是利用其溶解度比较小
B. 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
C. 在第③、④、⑤步骤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 22.4LCl2溶于足量水,所得溶液中Cl2、Cl-、HClO和ClO-四种微粒总数为NA
B. 标准状况下,38g3H2O2中含有3NA共价键
C. 常温下,将5.6g铁块投入足量浓硝酸中,转移0.3NA电子
D. 0.1molL-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
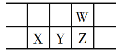
A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com