
 在电解冶炼铝的过程中加入冰晶石,可起到降低Al2O3熔点的作用.冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空:
在电解冶炼铝的过程中加入冰晶石,可起到降低Al2O3熔点的作用.冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空: .
.分析 (1)冰晶石(Na3AlF6)晶体不导电,但熔融时能导电,说明属于离子化合物,由Na+、[AlF6]3-构成,[AlF6]3-中含有配位键;
(2)CO2分子为直线形结构,可知碳原子采取sp杂化方式,原子数目相等、价电子总数也相等的微粒互为等电子体;
(3)元素的非金属性越强,其电负性越强,F元素电负性最大,F原子核外最外层电子排布式为2s22p5;
(4)利用均摊法计算晶胞中白色球、黑色球数目,再根据化学式判断;
(5)利用均摊法计算Al原子个数,表示出晶胞质量,面对角线上3个Al原子相邻,晶胞棱长为4d×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$d,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)冰晶石(Na3AlF6)晶体不导电,但熔融时能导电,说明属于离子化合物,由Na+、[AlF6]3-构成,[AlF6]3-中含有配位键,也属于极性键,
故选:abc;
(2)CO2分子为直线形结构,可知碳原子采取sp杂化方式,原子数目相等、价电子总数也相等的微粒互为等电子体,和CO2 互为等电子体的氧化物是N2O,
故答案为:直线形;sp;N2O;
(3)元素的非金属性越强,其电负性越强,所以电负性最强的是F元素;F原子核外最外层上s、p能级,s、p能级上电子分别是2、5,其最外层轨道表示式为 ,
,
故答案为:F; ;
;
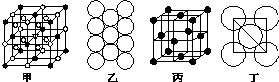
(4)●的个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,○个数=12×$\frac{1}{4}$+8=11,要使两种离子的个数之比为1:3,则大立方体的体心处所代表的微粒是Na+,
故答案为:Na+;
(5)晶胞中Al原子个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量4×$\frac{M}{N{\;}_{A}}$g,面对角线上3个Al原子相邻,晶胞棱长为4d×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$d,则晶胞密度=$\frac{\frac{M}{{N}_{A}}×4}{(2\sqrt{2}d){\;}^{3}}$g•cm-3=$\frac{M}{4\sqrt{2}d{\;}^{3}N{\;}_{A}}$g•cm-3;
故答案为:4;$\frac{M}{4\sqrt{2}d{\;}^{3}N{\;}_{A}}$.
点评 本题考查了物质的结构与性质,涉及化学键、空间构型与杂化方式、等电子体、核外电子排布、晶胞计算等,(5)中关键是明确原子半径与晶胞棱长关系掌握均摊法进行晶胞有关计算.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:解答题
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
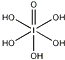 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
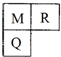 M、R、Q三种短周期元素在元素周期表中的相对位置如图所示,已知M、Q可分别与R形成化合物X和Y,M与R的质子数之和为Q的质子数,下列说法中,正确的是( )
M、R、Q三种短周期元素在元素周期表中的相对位置如图所示,已知M、Q可分别与R形成化合物X和Y,M与R的质子数之和为Q的质子数,下列说法中,正确的是( )| A. | ①②③④ | B. | ①②④ | C. | ②③ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
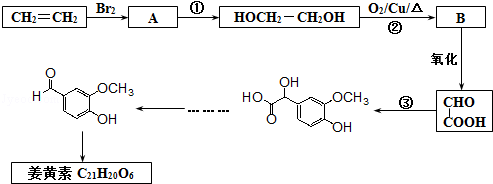
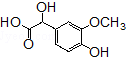 的含氧官能团的名称为醚键和羧基、羟基
的含氧官能团的名称为醚键和羧基、羟基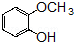
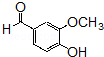 的同分异构体的结构简式
的同分异构体的结构简式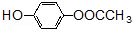
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6g 由NO2和N2O4组成的混合气体中含有的原子总数为0.3NA | |
| B. | 0.2 g D216O中含有的质子数,中子数,电子数均为0.1NA | |
| C. | 铁与足量稀硝酸反应时,生产0.1mol NO转移的电子数为0.3NA | |
| D. | 6.2克白磷分子(P4)中含P-P键为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
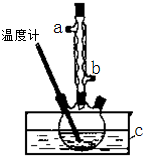 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去):
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com