
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素CO(NH2)2,原理如图。下列有关说法正确的是( )
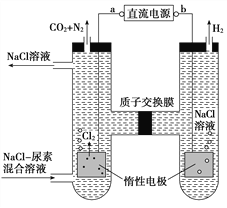
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 阳极室中发生的电极反应为2H++2e-=H2↑
D. 若两极共收集到气体产品13.44 L(标准状况),则除去的尿素为7.2 g(忽略气体的溶解)
【答案】B
【解析】试题分析:由图可知,左室电极产物为CO2和N2,发生氧化反应,故a为电源的正极,右室电解产物H2,发生还原反应,故b为电源的负极, A选项不正确;阴极反应为6H2O+6e-═6OH-+3H2↑(或6H++6e-═3H2↑),阳极反应为6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变, B选项不正确;由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,阳极室中发生的反应依次为:2Cl--2e-═Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,C选项不正确;电解收集到的13.44L气体,物质的量为=0.6mol,由反应CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl可知n(N2)=n(CO2)="0.6mol×1/5=0.12" mol,可知生成0.12mol N2所消耗的CO(NH2)2的物质的量也为0.12mol,其质量为:m[CO(NH2)2]="0.12" mol×60 gmol-1=7.2g,选项 D正确;


科目:高中化学 来源: 题型:
【题目】(1)常温下,0.05 mol/L的硫酸溶液的pH=___,水电离出的c(H+)=___mol/L。
(2)在常温下,水电离出的c(H+)=1×10-13 mol·L-1的NaOH溶液中,pH=__________,c(NaOH)=_______mol·L-1。
(3)某温度下,纯水的c(H+)=2×10-7 mol·L-1,则此时纯水的c(OH-)为________。若温度不变,滴入稀盐酸使c(H+)=5×10-4 mol·L-1,则溶液中c(OH-)为________,此时温度________(填“高于”、“低于”或“等于”)25℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除SO2、NOx对大气造成的污染具有重要现实意义。
(1)将一定量的空气样品用蒸馏水溶解制成待测试样(忽略OH-)。常温下测得该试样的组成及其浓度如下表:
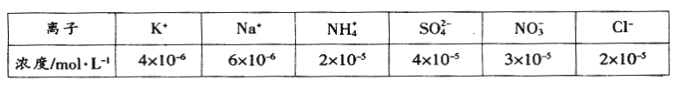
根据表中数据判断该试样的pH=____________。
(2)为减少SO2的排放,可将煤转化为清洁气体燃料,或将含SO2的烟气洗涤。
①已知:H2(g)+![]() O2(g)=H2O(g) △H=-241.8 kJ·mol-1
O2(g)=H2O(g) △H=-241.8 kJ·mol-1
C(s)+![]() O2(g)=CO(g) △H=-110.5 kJ·mol-1
O2(g)=CO(g) △H=-110.5 kJ·mol-1
写出焦炭与水蒸汽反应的热化学方程式____________。
②下列可作为洗涤含SO2烟气的洗涤剂是_________(填序号)。
A.浓氨水 B.碳酸氢钠饱和溶液
C.FeCl2饱和溶液 D.酸性CaCl2饱和溶液
(3)实验室中研究有无CO对NO的有效消除程度,测得NO的转化率随温度的变化曲线如图所示。当无CO时,温度超过750K,发现NO的分解率降低,其可能的原因是________。当有CO且n(CO)/n(NO)=1时,为更好地除去NO,应控制的最佳温度为________K左右。
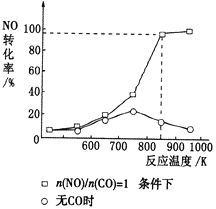
(4)用活性炭可处理大气污染物NO。在 5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
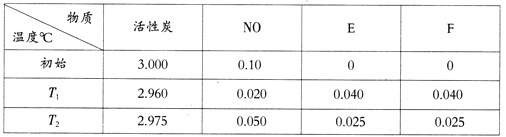
①写出NO与活性炭反应的化学方程式____________;
②若T1<T2,则该反应的△H________0(填“>”、“<”或“=”);
③上述反应T1℃时达到化学平衡后再通入0.1 mol NO气体,则达到新化学平衡时NO的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分挟持装置已略去)进行实验:
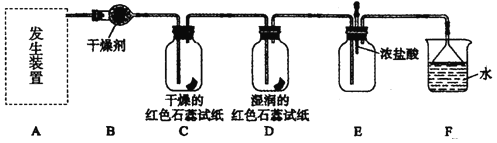
(1)写出实验室用固体制取氨气的化学方程式___________________________。
(2)利用上述原理,实验室制取氨气应选用下图中________发生装置进行实验。
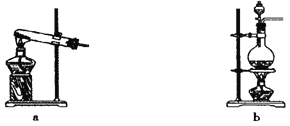
(3)B装置中的干燥剂可选用________(填“碱石灰”或“浓硫酸”)。
(4)气体通过C、D装置时,试纸颜色会发生变化的是________(填“C”或“D”),试纸颜色变为___________。
(5)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,发生的化学反应是____________可观察到的现象是____________。
(6)F装置的作用是____________,装置中倒扣的漏斗是为了_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1×105Pa、298K时,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g) = H2(g) + 1/2O2(g) △H= +242kJ·mol-1
B.2H2(g) + O2(g) = 2H2O(l) △H= +484kJ·mol-1
C.H2(g) + 1/2O2(g) = H2O(g) △H= +242kJ·mol-1
D.2H2(g) + O2(g) = 2H2O(g) △H= +484kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池的“理论比能量”指单位质量的电极材料理论上能释放的最大电能。“金属(M)空气电池”(如下图)具有原料易得、能量密度高等优点。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。下列说法不正确的是
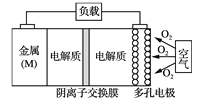
A. “金属(M)空气电池”放电过程的正极反应式: O2+2H2O+4e-=4OH-
B. 比较Mg、Al、Zn三种“金属—空气电池”,“Al—空气电池”的理论比能量最高
C. 电解质溶液中的阴离子从负极区移向正极区
D. 在“M—空气电池”中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要 0.5mol·L-1 的 NaOH 溶液 480mL,现欲配制此溶液,有以下仪器:①烧杯② 100mL 量筒 ③100mL 容量瓶④胶头滴管⑤玻璃棒⑥托盘天平(带砝码)⑦药匙
(1)配制时,必须使用的仪器有__(填代号),还缺少的仪器是 。该实 验中两次用到玻璃棒,其作用分别是_________________,__________________ 。
(2)配制溶液时,一般可以分为以下几个步骤: ① 称量、②计算、 ③溶解、 ④倒转摇匀、⑤ 转移、⑥洗涤、⑦定容、⑧冷却,其正确的操作顺序为__(用序号填 空),其中在①操作中需称量 NaOH 的质量为______________g。
(3)下列操作结果会使溶液的物质的量浓度偏低的是_________。
A.没有将洗涤液转入容量瓶中
B.称量时用了生锈的砝码
C.定容时,俯视容量瓶的刻度线
D.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度
(4)若某学生用托盘天平称量药品时,在托盘天平左盘放有 20g 砝码,天平达平衡时游码的位置如图,则该同学所称量药品的实际质量为_________g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 5.6 g Fe在氧气中燃烧,完全反应时转移电子数为0.3NA
B. 标准状况下,22.4 L氦气与22.4 L氯气所含原子数均为2 NA
C. 32 gCu与S完全反应转移的电子数为0.5NA
D. 1mol O2与足量Na反应,生成Na2O和Na2O2的混合物转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X2(g)+Y2(g)2Z(g),已知X2、Y2、Z起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度可能是
A. c(Z)=0.4 mol/L B. c(X2)=0.2mol/L
C. c(Y2)=0.4mol/L D. c(X2)+c(Y2)+c(Z)=0.6mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com