
| t/min | 0 | 20 | 40 | 60 | 80 |
| c(H2O2)/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
分析 (1)有电子转移的化学反应是氧化还原反应,其特征是有元素化合价升降;
(2)v(H2O2)=$\frac{△c}{△t}$;
(3)0─80min内消耗n(H2O2)=(0.80-0.08)mol/L×0.1L=0.075mol,根据双氧水和氧气的关系式计算氧气物质的量,再根据m=nM计算氧气质量.
解答 解:(1)有电子转移的化学反应是氧化还原反应,其特征是有元素化合价升降,该反应中O元素化合价由-1价变为0价、-2价,所以有电子转移,为氧化还原反应,
故答案为:是;
(2)v(H2O2)=$\frac{△c}{△t}$=$\frac{(0.80-0.40)mol/L}{(20-0)min}$=0.02mol/(L.min),
故答案为:0.02;
(3)0─80min内消耗n(H2O2)=(0.80-0.05)mol/L×0.1L=0.075mol,根据双氧水和氧气的关系式得n(O2)=$\frac{1}{2}$n(H2O2)=0.0375mol,氧气质量m=nM=0.0375mol×32g/mol=1.2g,
故选C.
点评 本题考查氧化还原反应判断、根据方程式的计算、化学反应速率计算等基本计算、概念,侧重考查学生分析计算能力,注意氧化还原反应本质和特征区别,题目难度不大.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
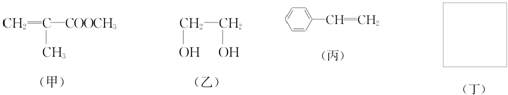
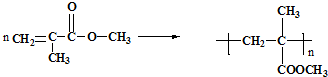
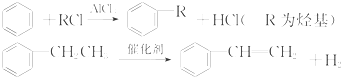 利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是 +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$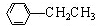 +HCl.
+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下能溶于水 | B. | 水溶液能导电 | C. | 具有较高的熔点 | D. | 熔融状态能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+和CH4属于等电子体,立体构型都是正四面体 | |
| B. | 主族元素的原子核外电子最后填入的能级是s能级或p能级 | |
| C. | BF3、NCl3、H2O分子中所有原子都满足最外层为8电子结构的是NCl3 | |
| D. | 向盛有硫酸铜溶液的试管里加入过量氨水,将得到蓝色的氢氧化铜沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 种 | B. | 2 种 | C. | 3 种 | D. | 4 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ②③④⑥ | C. | ②③⑤⑥ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com