
 A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28.请回答下列问题:
A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C和D的最外层电子数之和为11,C、D、F三种元素的原子序数之和为28.请回答下列问题:分析 A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,则A为氢元素;A与E同一主族,E原子序数比A至少大4,可推知E为Na;B、C、D为同一周期,应处于第二周期,E、F、G、H都处于第三周期,C和D的最外层电子数之和为11,则二者核外电子数之和为2+2+11=15,C、D、F三种元素的原子序数之和为28,则F的原子序数=28-15=13,故F为Al元素;B与G,G的原子序数大于Al,则二者族序数大于Ⅲ,D与H为同一主族,又C、D原子序数之和为15,可推知B为碳元素、C为N元素、D为O元素、G为Si、H为S元素,据此解答.
解答 解:A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,则A为氢元素;A与E同一主族,E原子序数比A至少大4,可推知E为Na;B、C、D为同一周期,应处于第二周期,E、F、G、H都处于第三周期,C和D的最外层电子数之和为11,则二者核外电子数之和为2+2+11=15,C、D、F三种元素的原子序数之和为28,则F的原子序数=28-15=13,故F为Al元素;B与G,G的原子序数大于Al,则二者族序数大于Ⅲ,D与H为同一主族,又C、D原子序数之和为15,可推知B为碳元素、C为N元素、D为O元素、G为Si、H为S元素.
(1)B与D可形成非极性分子X为CO2,其结构式为O=C=O,故答案为:O=C=O;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->Na+>Al3+,
故答案为:S2->Na+>Al3+;
(3)G的最高价氧化物为SiO2,与B的单质(碳)在高温下能发生置换反应,其化学反应方程式为:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
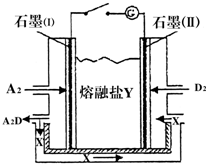
(4)盐Y由C、O、Na组成,则Y为Na2CO3,以熔融盐Na2CO3为电解质、氢气、氧气构成的燃料电池,由图可知石墨(I)是氢气失去电子,与碳酸结合生成水与二氧化碳,电极反应式:H2+CO32--2e-=H2O+CO2,
故答案为:H2+CO32--2e-=H2O+CO2;
(5)电解发生反应:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,相当于从溶液中析出CuO、失去部分水,向溶液中加入0.1mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,将Cu(OH)2可以改写为CuO.H2O,电解中生成Cu为0.1mol,2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑中电解的水为0.1mol,整个过程转移电子为0.1mol×2+0.1mol×2=0.4mol,
故答案为:0.4mol;
(6)由H、N、O、Na四种元素中任意三种构成的强电解质Z和W,溶于水时都能促进水的电离,发生盐类水解,测得Z的水溶液pH>7,W的水溶液pH<7,则Z为NaNO2、W为NH4NO3,
故答案为:NaNO2;NH4NO3.
点评 本题结构性质位置关系综合应用、原电池、电解计算、盐类水解等,推断元素是解题关键,侧重考查学生分析推理能力,(5)中关键是明确溶液复原时少什么加什么原则,注意运用化学式改写进行解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用活性炭除去冰箱中的异味是发生了化学反应 | |
| B. | 碘是人体必需微量元素,所以要多吃富含碘化钾的食物 | |
| C. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 | |
| D. | 航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升温能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| B. | 具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应 | |
| C. | 增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大 | |
| D. | 催化剂不影响反应活化能,从而只影响反应速率不影响化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制Na2S溶液时,为了抑制S2-的水解,常加入少量氢氧化钠 | |
| B. | 明矾用于净水过程只发生物理变化 | |
| C. | 把纯水加热水的电离程度增大,但水仍然是中性的,pH=7 | |
| D. | 加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a mol FeBr2溶液中通入a mol Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| B. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I-═3I2+2H2O | |
| C. | 向50mL 1mol•L-1明矾溶液中滴入数滴0.1mol•L-1Ba(OH)2溶液:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| D. | 在澄清石灰水中加入少量碳酸氢镁溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液:c (SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| B. | 0.1mol•L-1pH为4的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-) | |
| C. | 0.1 mol•L-1 Na2S溶液中:2c(Na+)═c(S2-)+c(HS-)+c(H2S) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)═c(OH-)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com