
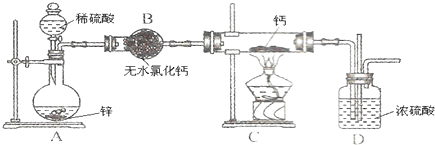
分析 氢化钙的制备:锌和稀硫酸反应:Zn+H2SO4=ZnSO4+H2↑,氢气中含有水蒸气,通过无水氯化钙进行干燥,在装置C中和钙进行反应Ca+H2$\frac{\underline{\;\;△\;\;}}{\;}$CaH2,生成氢化钙,因氢化钙遇水立即反应生成氢氧化钙和氢气,所以D防止空气中的水蒸气进行C中,
(1)H2在发生加热反应之前需要干燥,一般用无水氯化钙,防止空气中的水蒸气进入C装置;
(2)有气体参加加热或燃烧的反应需要首先验纯,实验完毕后先熄火、冷却,再停止气体生成,防止倒吸发生爆炸;
(3)检验是否干燥用无水硫酸铜;
(4)氢化钙和水反应生成氢氧化钙和氢气,钙和水反应也生成氢氧化钙和氢气;
(5)从最终称量碳酸钙可知,应加入碳酸盐溶液,使CaH2反应的同时得到碳酸钙沉淀,然后经过滤、洗涤、烘干、称量,确定纯度;
(6)生成氢气44.8L,所以氢气的质量为:$\frac{44.8L}{22.4L/mol}$×2g/mol=4g,设混合物中氢化钙的质量为x,生成氢气质量为y,则钙的质量为45.8g-x,钙与水反应生成氢气质量为4g-y,根据方程式CaH2+2H2O═Ca(OH)2+2H2↑、Ca+2H2O═Ca(OH)2+H2↑,列方程计算x、y的值,再根据质量分数定义计算.
解答 解:(1)氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气,H2在发生加热反应之前需要干燥,一般用无水氯化钙,故装置B的作用是:除去氢气中的水蒸气;
故答案为:除去氢气中的水蒸气;
(2)有气体参加加热或燃烧的反应需要首先验纯,实验完毕后先熄火、冷却,再停止气体生成,防止倒吸发生爆炸,故正确的操作顺序为:②①④③;
故答案为:②①④③;
(3)检验是否干燥用无水硫酸铜,因为无水硫酸铜遇水变蓝色现象很明显;
故答案为:无水硫酸铜;
(4)①氢化钙和水反应生成氢氧化钙和氢气,反应方程式为:CaH2+2H2O=Ca(OH)2+2H2↑;
故答案为:CaH2+2H2O=Ca(OH)2+2H2↑;
②钙和氢化钙与水反应现象相同,所以该同学判断不严密;
故答案为:钙与水反应时也有相同现象;
(5)从最终称量碳酸钙可知,应加入碳酸钠溶液,使CaH2反应的同时得到碳酸钙沉淀,然后经过滤、洗涤、烘干、称量,确定纯度,
故答案为:Na2CO3;过滤;
(6)生成氢气44.8L,所以氢气的质量为:$\frac{44.8L}{22.4L/mol}$×2g/mol=4g,设混合物中氢化钙的质量为x,生成氢气质量为y,则钙的质量为45.8g-x,钙与水反应生成氢气质量为4g-y,则:
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
x y
所以42:4=x:y,整理的y=$\frac{2x}{21}$,
Ca+2H2O═Ca(OH)2+H2↑
40 2
45.8-x 4-y
所以40:2=(45.8-x):(4-y),将y=$\frac{2x}{21}$代入,解得x=43.3g,所以样品中氢化钙的纯度为:$\frac{43.3g}{45.8g}×100%$=94.54%;
故答案为:94.54%.
点评 本题以氢化钙制备为载体,考查实验基本技能与操作、对题中的信息的利用、对实验装置的理解分析、物质分离提纯、化学计算、实验方案设计等,是对学生综合能力的考查,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 镀锌制品镀层破损后,该铁制品比受损前更容易生锈 | |
| C. | 水中加入少量氯化铁固体,溶液中水的电离平衡会向右移动 | |
| D. | pH=3的盐酸与pH=10的某碱溶液等体积混合溶液呈碱性,说明该碱为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ | |
| C. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| D. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 吗替麦考酚酯的分子式为C23H30O7N | |
| B. | 吗替麦考酚酯可发生加成、取代、消去反应 | |
| C. | 吗替麦考酚酯分子中所有碳原子一定处于同一平面 | |
| D. | 1mol吗替麦考酚酯与NaOH溶液充分反应最多消耗3mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
实验序号 | 反应温度/℃ | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/ml | c/(mol•L-1) | V/ml | c/(mol•L-1) | V/ml | ||
| A | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 5 | 0.1 | 5 | 0.1 | 10 |
| 预测 | 实验操作 | 实验现象 | ?现象解释 | |
| 探究① | Na2S2O3溶液呈碱性 | 溶液pH=8 | S2O32-+H2O HS2O3-+OH- | |
| 探究② | Na2S2O3有还原性 | 向新制氯水中滴加Na2S2O3溶液 | 氯水颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | 乙烯能与高锰酸钾发生氧化还原反应 |
| B | 用Na2S除去废水中的Cu2+和Hg2+ | Na2S具有强还原性 |
| C | 用氧化铁制作红色涂料 | 氧化铁能与酸反应 |
| D | 用明矾溶液清除铜镜表面的铜锈 | 明矾溶液中Al3+能与铜锈反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com