
【题目】以黄铜矿(主要成分二硫化亚铁铜CuFeS2为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是:CuFeS2+4Fe3+=Cu2++5Fe2++2S
(1)上述总反应的原理如图1所示。正极的电极反应式是_______________________________。
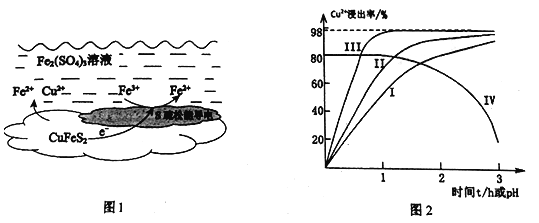
(2)一定温度下,控制浸取剂pH=1,总体积为1L,取三份相同质量黄铜矿粉末分别进行实验,结果如图2:
实验 | 操作 |
I | 加入足量0.100 molL-1Fe2(SO4)3溶液 |
II | 加入足量0.100 molL-1Fe2(SO4)3溶液,通入空气 |
Ⅲ | 加入足量0.100 molL-1Fe2(SO4)3溶液,再加入少量 0.000500 molL-1Ag2SO4溶液 |
①曲线IV是在实验I的基础上改变溶液的pH所得实验结果,请分析pH从2到3,Cu2+浸出率明显下降的原因____________________________(用离子方程式描述)。
②对比实验I、Ⅱ,通入空气,Cu2+浸出率提髙的原因是_________________________。
③由实验Ⅲ推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
i . CuFeS2+4Ag+=Fe2++Cu2++2Ag2S
ii.……
写出上述ii的离子方程式_____________________________________________。
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005mol·L-lAg2SO4溶液,充分混合后静置。取上层淸液,加入稀盐酸,观察到溶液中_______________________,证明发生反应i
b.取少量Ag2S粉末,加入________________溶液,充分混合后静置。取上层淸液,加入稀盐酸,有白色沉淀,证明发生反应ii
④若实验中样品含铜a mol,则实验I的平衡常数K=_____________(杂质不参与反应,只要求列出计算式,不必算出结果)。
(3)为了进一步研究上述实验Ⅲ结论的可靠性,査得资料Ksp(Ag2S)=6.4×10-50,Ksp(AgCl)=1.8×10-10,试计算,使饱和Ag2S溶液中的Ag+开始转化为AgCl沉淀所需盐酸的最低浓度为____________ mol/L (己知![]() ≈2.5)。
≈2.5)。
【答案】 Fe3++e-=Fe2+ 2Fe3++3H2O![]() 2Fe(OH)3+3H+ 通入O2后,Fe2+被氧化为Fe3+, c(Fe2+)降低,c(Fe3+)升高,平衡正向移动 Ag2S+2 Fe3+=2Ag++2 Fe2++ S 无明显现象 Fe2(SO4)3溶液 K=
2Fe(OH)3+3H+ 通入O2后,Fe2+被氧化为Fe3+, c(Fe2+)降低,c(Fe3+)升高,平衡正向移动 Ag2S+2 Fe3+=2Ag++2 Fe2++ S 无明显现象 Fe2(SO4)3溶液 K=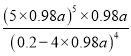 3.6×106【不可能达到的浓度,侧面说明a的检验方法可行】
3.6×106【不可能达到的浓度,侧面说明a的检验方法可行】
【解析】(1)考查电极反应式的书写,正极是得到电子,化合价降低,根据图,Fe3+在正极上参加反应,电极反应式为Fe3++e-=Fe2+;(2)考查盐类水解、平衡的移动、化学平衡常数,①浸取剂是Fe2(SO4)3,属于强酸弱碱盐,Fe3++3H2O![]() Fe(OH)3+3H+,pH从2到3,溶液中c(H+)降低,平衡向正反应方向进行,生成Fe(OH)3,c(Fe3+)降低,平衡向逆反应方向移动,Cu2+浸取率降低;②Fe2+以还原性为主,容易被氧气氧化成Fe3+,溶液中c(Fe3+)增大,平衡向正反应方向移动,Cu2+浸取率提高;③因为Ag+是催化剂,因此反应后仍然生成Ag+,且Fe3+参加反应,因此ii的反应是Ag2S+2Fe3+=2Ag++2Fe2++S;a、因为加入少量Ag2SO4溶液,反应i,溶液中没有Ag+存在,因此加入盐酸后,没有沉淀产生,即无现象;b、根据ii的反应,应加入Fe2(SO4)3溶液,混合后静置,取上层清液,加入稀盐酸,有白色沉淀产生,说明反应ii发生;④CuFeS2+4Fe3+
Fe(OH)3+3H+,pH从2到3,溶液中c(H+)降低,平衡向正反应方向进行,生成Fe(OH)3,c(Fe3+)降低,平衡向逆反应方向移动,Cu2+浸取率降低;②Fe2+以还原性为主,容易被氧气氧化成Fe3+,溶液中c(Fe3+)增大,平衡向正反应方向移动,Cu2+浸取率提高;③因为Ag+是催化剂,因此反应后仍然生成Ag+,且Fe3+参加反应,因此ii的反应是Ag2S+2Fe3+=2Ag++2Fe2++S;a、因为加入少量Ag2SO4溶液,反应i,溶液中没有Ag+存在,因此加入盐酸后,没有沉淀产生,即无现象;b、根据ii的反应,应加入Fe2(SO4)3溶液,混合后静置,取上层清液,加入稀盐酸,有白色沉淀产生,说明反应ii发生;④CuFeS2+4Fe3+ ![]() Cu2++5Fe2++2S
Cu2++5Fe2++2S
起始: a 0.2 0 0
变化:0.98a 4×0.98a 0.98a 5×0.98a
平衡: (0.2-4×0.98a) 0.98a 5×0.98a 根据平衡常数的定义,K= 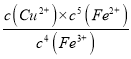 ==
==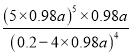 ;(3)本题考查溶度积的计算,饱和Ag2S溶液中c(Ag+)=
;(3)本题考查溶度积的计算,饱和Ag2S溶液中c(Ag+)= ![]() mol·L-1=5×10-17mol·L-1,加入Cl-,AgCl达到饱和,至少需要的c(Cl-)=
mol·L-1=5×10-17mol·L-1,加入Cl-,AgCl达到饱和,至少需要的c(Cl-)=  =3.6×106mol·L-1,因此出现氯化银沉淀,需要盐酸的最低浓度为3.6×106mol·L-1。
=3.6×106mol·L-1,因此出现氯化银沉淀,需要盐酸的最低浓度为3.6×106mol·L-1。


科目:高中化学 来源: 题型:
【题目】下列关于氯气、氯水的叙述中正确的是( )
A. 氯气、液氯、氯水是同一种物质
B. 新制氯水可以使蓝色石蕊试纸先变红后褪色
C. 光照氯水有气泡逸出,逸出的气体是氯气
D. 新制氯水放置数天后pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 处于最低能童的原子叫做基态原子
B. 对于组成和结构相似的分子,其范德华力随若相对分子质量的增大而增大
C. 化学键可以是原子间作用力,也可以是离子间作用力
D. 3p2表示3p能级有两个轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属铝的叙述中,正确的是
A. 铝是地壳中含量最多的元素
B. 铝是比较活泼的金属,在化学反应中容易失去电子,表现氧化性
C. 与铝反应产生H2的溶液一定呈酸性
D. 铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】链型的不饱和油酸(C17H33COOH)与蔗糖反应可以制得非天然油脂,其反应示意图如图所示(图中的反应式不完整),则下列说法不正确的是
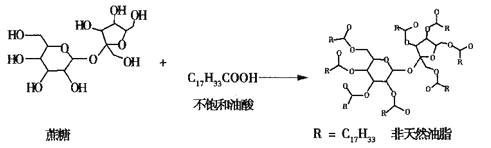
A. 蔗糖、葡萄糖分别与银氨溶液水浴加热反应,有相同的实验现象
B. 天然油脂、蔗糖、非天然油脂都能发生水解反应
C. 该非天然油脂与氢氧化钠溶液共热,产物可与溴的四氯化碳溶液反应
D. 植物油、非天然油脂都可以与H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明因胃部不适去医院检查,医生告之是由于“胃酸过多”引起,建议服用抑酸剂。下列药物可作抑酸剂的是
A. 维生素C B. 阿司匹林
C. 复方氢氧化铝片 D. 葡萄糖口服液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用坩埚钳夹住一小块刚用酸充分处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释正确的是
A. 火焰温度太低不能使铝燃烧
B. 铝在空气中不能很快形成氧化膜
C. 氧化铝的熔点比铝的熔点高
D. 用酸处理时未能将氧化铝溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
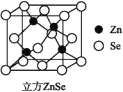
【题目】
硒化锌是一种透明色半导体,也可作为红外光学材料,熔点是1 520 ℃。
(1)基态锌原子的价电子排布式是________。
(2)根据元素周期律,电负性Se________S,第一电离能Se________As(填“>”或“<”)。
(3)H2S分子的电子式:________,H2Se分子构型是_______,
其中硒原子的杂化轨道类型是________。
(4)H2O的沸点高于H2Se的沸点(-42 ℃),其原因是________。
(5)晶体Zn为六方最密堆积,其配位数是________。
(6)ZnSe晶胞如图,假设阿伏加德罗常数的值为NA,则144 g ZnSe晶体中的晶胞数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁及其化合物的说法中正确的是
A. Fe3+与KSCN产生血红色沉淀
B. 铁与水蒸气在高温下的反应产物为Fe2O3和H2
C. 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入过量铁粉,然后过滤
D. 赤铁矿的主要成分是Fe3O4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com