
| A. | 酸、碱、盐、氧化物在组成上的共同点是都含有非金属元素 | |
| B. | 只含有一种元素的物质都是纯净物 | |
| C. | 制糖工业中利用活性炭脱色制白糖的过程是物理变化 | |
| D. | 压强恒定时,气体在水中的溶解度随温度的升高而降低 |
分析 A.酸中一定有氢元素、碱中一定含有氢氧元素、盐中因含有酸根也一定含有非金属元素、氧化物中一定含有氧元素;
B.可能是混合物(如O2、O3);
C.吸附的过程没有生成新物质;
D.气体的溶解度随温度的升高而降低.
解答 解:A.由四类物质的概念可知;酸中一定有氢元素、碱中一定含有氢氧元素、盐中因含有酸根也一定含有非金属元素、氧化物中一定含有氧元素,所以酸、碱、盐、氧化物在组成上的共同点是都含有非金属元素的说法正确,故A正确;
B.只含有一种元素的物质可能是纯净物(如O2),也可能是混合物(如O2、O3),故B错误;
C.活性炭在吸附色素时没有生成新的物质,发生的是物理变化,故C正确;
D.有影响气体溶解度的条件可知:压强恒定时,气体在水中的溶解度随温度的升高而降低,故D正确.
故选B.
点评 本题考查物质的组成与分类,题目难度不大,主要涉及到了气体溶解度的影响因素,对于气体而言溶解度随温度的升高而降低,随压强的增大而增大.


科目:高中化学 来源: 题型:解答题
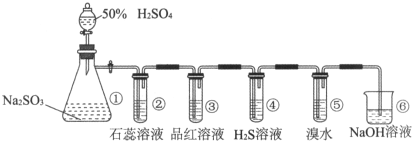
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①⑤⑥ | C. | ②③④ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
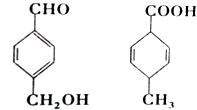
| A. | 互为同分异构体 | |
| B. | 均能使酸性高锰酸钾溶液褪色 | |
| C. | 均可以发生加成和取代反应 | |
| D. | 既能用红外光谱区分,也可以用核磁共振氢谱区分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向其中再加入少量醋酸钠晶体时,溶液中所有离子浓度都增大 | |
| B. | 离子浓度大小比较:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 向其中加入盐酸至恰好呈中性时,c(Na+)=c(CH3COO-) | |
| D. | 加水稀释时$\frac{c(C{H}_{3}C{O}^{-})}{c(N{a}^{+})}$的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HCO3-)>c(H+)>c(OH-) | B. | c(Na+)=c(HCO3-)+c(CO32-)+2c(H2CO3) | ||
| C. | c(H+)+c(H2CO3)=c(OH-) | D. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
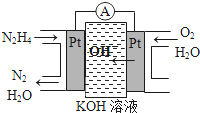 某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:
某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com