
| A. | 原子半径:PO>Te | B. | 为非金属元素 | ||
| C. | ${\;}_{84}^{209}$PO的中子数为125 | D. | 在周期表中第六周期 |
分析 ${\;}_{84}^{209}$PO位于周期表第六周期、VIA族,为金属元素,质子数数为84,质量数为209,可知中子数,结合同主族元素的性质的递变规律解答该题.
解答 解:A.同主族元素从上到下原子 半径逐渐增大,故A正确;
B.Po在周期表中,位于Te的下一周期,为金属元素,故B错误;
C.质子数数为84,质量数为209,中子数为209-84=125,故C正确;
D.质子数为84,核外各层电子数分别为2、8、18、32、18、6,核外共6个电子层,位于周期表中第六周期,故D正确.
故选B.
点评 本题考查元素在周期表中的位置以及性质的递变规律,为高频考点,侧重考查学生的分析能力,把握原子结构与元素周期表、周期率的关系,题目难度不大.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子序数为15的元素的最高化合价为+3 | |
| B. | ⅦA族元素是同周期中非金属性最强的元素 | |
| C. | 第二周ⅣA族元素的原子核电荷数和中子数一定为6 | |
| D. | IA族元素的金属性一定比ⅡA族元素的金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质参加或单质生成的化学反应一定是氧化还原反应 | |
| B. | 金属阳离子只有氧化性 | |
| C. | SO2具有较强还原性,浓H2SO4有很强的氧化性,不能用浓H2SO4干燥SO2 | |
| D. | 1molFe溶于过量硝酸,转移3mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)写出基态镍原子的价电子排布图
(1)写出基态镍原子的价电子排布图 .
. )分子中2号碳原子的杂化方式为sp2杂化;与CS2互为等电子体的离子是SCN-(写一种).
)分子中2号碳原子的杂化方式为sp2杂化;与CS2互为等电子体的离子是SCN-(写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
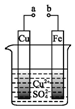
| A. | a和b用导线连接时,铜片上发生的反应为:Cu2++2e-═Cu | |
| B. | a和b不连接时,铁片上会有红色铜析出 | |
| C. | a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
 (标出配位键).
(标出配位键).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石比石墨稳定 | |
| B. | 1g石墨完全燃烧放出的热量比1g金刚石完全燃烧放出的热量多 | |
| C. | 能量低的状态更稳定,所以自然界的物质都以能量最低的形态存在 | |
| D. | 等质量的石墨和金刚石中所含原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com