
| 物质 | H2CO3 | HClO | HAlO2 |
| 电离常数 (25℃) | Ka1=4.4×10-7 | Ka=3×10-8 | Ka=6.3×10-13 |
| Ka2=4.7×10-11 |
| A. | NaClO溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | NaAlO2溶液中加入过量CO2:AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓ | |
| D. | NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═CO32-+2Al(OH)3↓ |
分析 依据电离常数大小判断酸性强弱,H2CO3>HClO>HCO3->HAlO2,依据强酸制备弱酸规律结合反应物用量对产物影响解答.
因为次氯酸酸性弱于碳酸,强于碳酸氢根根离子,所以次氯酸钠与二氧化碳反应,无论二氧化碳量多少,反应都生成碳酸氢钠和次氯酸;
因为偏铝酸酸性弱于碳酸碳酸、碳酸氢根离子,所以偏铝酸钠与二氧化碳反应,二氧化碳少量反应生成氢氧化铝和碳酸根离子,继续通入二氧化碳,二氧化碳与生成的碳酸根离子反应生成碳酸氢根离子.
解答 解:A.碳酸酸性强于次氯酸,次氯酸酸性强于碳酸氢根离子,所以NaClO溶液中通入CO2反应生成次氯酸和碳酸氢根离子,离子方程式:ClO-+CO2+H2O═HClO+HCO3-,
故A正确;
B.碳酸酸性强于次氯酸,次氯酸酸性强于碳酸氢根离子,NaClO溶液中通入少量CO2反应生成次氯酸和碳酸氢根离子,离子方程式:ClO-+CO2+H2O═HClO+HCO3-,故B错误;
C.碳酸、碳酸氢根离子酸性都强于偏铝酸,则NaAlO2溶液中加入过量CO2,反应生成碳酸氢根离子和氢氧化铝沉淀,离子方程式:AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓,故C正确;
D.碳酸、碳酸氢根离子酸性都强于偏铝酸,则NaAlO2溶液中加入过量CO2,反应生成碳酸根离子和氢氧化铝沉淀,离子方程式:2AlO2-+CO2+3H2O═CO32-+2Al(OH)3↓,故D正确;
故选:B.
点评 本题考查了离子方程式的书写,依据图表准确判断酸性强弱、明确强酸制备弱酸规律是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | FeBr2溶液中通入少量Cl2:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 酸性高锰酸钾溶液中加入草酸:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| C. | 硫代硫酸钠溶液中加入稀硫酸:2H++S2O32-═S↓+SO2↑+H2O | |
| D. | 将氧气通入酸性碘化钾溶液中:2I-+O2+4H+═I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯和溴水混合后加入铁粉制取湨苯 | |
| B. | 检验溴乙烷中的湨元素的方法是加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| C. | 将硝酸银溶液加入到浓氨水中配成银氨溶液后,滴加几滴乙醛加热煮沸制银镜 | |
| D. | 蒸馏操作中,将温度计放置在蒸馏烧瓶支管口附近 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H5CH2COOH | B. | C6H5COOH | C. | C6H13COOH | D. | C7H15COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl溶液呈酸性:NH4++2H2O?NH3•H2O+H3O+ | |
| B. | 氨气溶于水,溶液呈碱性:NH3•H2O═NH4++OH- | |
| C. | NaHSO4溶液可以导电:NaHSO4?Na++H++SO42- | |
| D. | 常温下,饱和H2CO3溶液pH=4:H2CO3?2H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HCl>HI | B. | O2和O3互为同素异形体 | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 干冰和冰为同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 原因 | 结论 |
| A | 乙烯和苯都能使溴水褪色 | 苯和乙烯分子都含有碳碳双键 |
| B | 乙酸乙酯和乙烯一定条件下都能和水反应 | 两者属于同一类型的反应 |
| C | 乙酸和葡萄糖都能与新制的氢氧化铜悬浊液反应 | 两者所含的官能团相同 |
| D | 乙烯能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色 | 两者褪色的本质不相同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
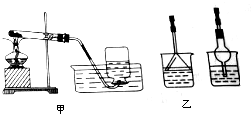 在实验室里用KClO3和MnO2的混合物加热制取少量的氧气,装置如图甲.实验结束后要先取出导气管,后撤走酒精灯,以防止水倒吸回试管的受热部分,引起试管的破裂.
在实验室里用KClO3和MnO2的混合物加热制取少量的氧气,装置如图甲.实验结束后要先取出导气管,后撤走酒精灯,以防止水倒吸回试管的受热部分,引起试管的破裂.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com