
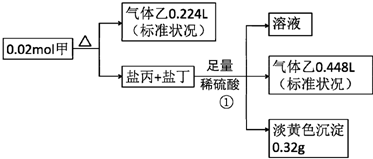
分析 甲的焰色为黄色,含有Na元素,盐丙和丁的组成元素和甲相同,加入足量硫酸反应生成的乙能使品红溶液褪色,则乙为SO2,生成的淡黄色沉淀为S,丙、丁中其中一种为Na2S2O3,发生反应:Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O,反应①生成的二氧化硫为$\frac{0.448L}{22.4L/mol}$=0.02mol,硫为0.32g即0.01mol,而Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O中生成的S、SO2均为0.01mol,故丙、丁中其中一种为Na2SO3,发生反应:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,该反应生成SO2为0.02mol-0.01mol=0.01mol,结合方程式可知,Na2S2O3为0.01mol,Na2SO3为0.01mol,甲分解得到硫为$\frac{0.32g}{32g/mol}$=0.01mol,根据原子守恒可知,0.02mol甲中含有:Na原子为0.01mol×2+0.01mol×2=0.04mol,S原子为0.01mol+0.01mol×2+0.01mol=0.04mol,O原子为(0.01mol+0.01mol)×3+0.01mol×2=0.08mol,则1mol甲含有2molNa原子、2molS原子、4molO原子,故甲的化学式为Na2S2O4,以此解答该题.
解答 解:甲的焰色为黄色,含有Na元素,盐丙和丁的组成元素和甲相同,加入足量硫酸反应生成的乙能使品红溶液褪色,则乙为SO2,生成的淡黄色沉淀为S,丙、丁中其中一种为Na2S2O3,发生反应:Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O,反应①生成的二氧化硫为$\frac{0.448L}{22.4L/mol}$=0.02mol,硫为0.32g即0.01mol,而Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O中生成的S、SO2均为0.01mol,故丙、丁中其中一种为Na2SO3,发生反应:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,该反应生成SO2为0.02mol-0.01mol=0.01mol,结合方程式可知,Na2S2O3为0.01mol,Na2SO3为0.01mol,甲分解得到硫为$\frac{0.32g}{32g/mol}$=0.01mol,根据原子守恒可知,0.02mol甲中含有:Na原子为0.01mol×2+0.01mol×2=0.04mol,S原子为0.01mol+0.01mol×2+0.01mol=0.04mol,O原子为(0.01mol+0.01mol)×3+0.01mol×2=0.08mol,则1mol甲含有2molNa原子、2molS原子、4molO原子,故甲的化学式为Na2S2O4,
(1)由以上分析可知甲为Na2S2O4,故答案为:Na2S2O4;
(2)①中产生黄色沉淀的反应的离子反应方程式:S2O32-+2H+=S↓+SO2↑+H2O,故答案为:S2O32-+2H+═S↓+SO2↑+H2O;
(3)甲具有还原性,氯气具有氧化性,硝酸银溶液显酸性,具有氧化性,二者可能与甲反应,故答案为:BC;
(4)Na2S2O4的溶液还可用作分析化学中的吸氧剂,假设其溶液与少量氧气反应产生等物质的量的两种酸式盐,硫元素化合价升高,反应生成NaHSO3、NaHSO4,该反应的化学反应方程式:Na2S2O4+O2+H2O=NaHSO3+NaHSO4,
故答案为:Na2S2O4+O2+H2O═NaHSO3+NaHSO4;
(5)某小组同学分别将乙通入品红的水溶液和品红的乙醇溶液,发现前者红色褪去,后者红色不变,品红中含有亚硫酸,而乙醇含有二氧化硫,说明使品红褪色的不是SO2分子;使品红褪色的有可能是亚硫酸分子、亚硫酸氢根或者亚硫酸根中的一种,
故答案为:使品红褪色的不是SO2分子,使品红褪色的有可能是亚硫酸分子、亚硫酸氢根或者亚硫酸根中的一种.
点评 本题考查无机物推断,为高频考点,侧重于学生的分析、计算能力的考查,属于计算型推断,关键是根据气体乙的性质及淡黄色沉淀判断丙、丁其中一种为Na2S2O3,需要学生具备扎实的基础,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径逐渐减小 | B. | 元素原子得电子能力逐渐增强 | ||
| C. | 气态氢化物稳定性逐渐增强 | D. | 最高化合价逐渐增高 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
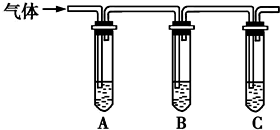 NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+═Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.
NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+═Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况.| 所加试剂 | 预期现象和结论 |
| 向试管A中加足量①1.0mol/LK淀粉溶液; 试管B中加1%品红溶液; 试管C中加②澄清石灰水. | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊,则消毒液部分变质; ③若A中溶液变蓝色,B中溶液不退色(无变化),C中溶液不变浑浊(无变化),则消毒液未变质,则消毒液未变质; ④若A中溶液不变蓝色(无变化),B中溶液不退色(无变化),C中溶液变浑浊则消毒液完全变质,则消毒液完全变质. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
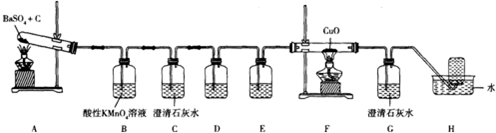
| 方案 | 操作过程及现象 |
| 甲 | 向第l支试管中滴加稀盐酸,将产生的气体通入溴水中,溴水褪色 |
| 乙 | 向第2支试管中滴加稀盐酸,将产生的气体分别通入品红溶液、CuSO4溶液中,品红溶液无变化,CuSO4溶液中产生黑色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高压钠灯发出的黄光射程远.透雾能力强,常用于道路和广场的照明 | |
| B. | 镁合金密度小,硬度和强度大,可用于制造火箭、导弹和飞机的部件 | |
| C. | 水玻璃常用于浸泡有特殊用途的木材、纺织品等达到耐腐蚀和防火的目的 | |
| D. | 氢氧化铁胶体具有吸附性,能吸附水中的悬浮颗粒并沉降,可用作消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL20mol/L 浓硫酸与足量锌反应,转移电子数为 0.2NA | |
| B. | 0.1mol24Mg18O 晶体中所含中子总数为 2.0NA | |
| C. | 在标准状况下,2.8gN2和 2.24LCO 所含电子数均为 1.4NA | |
| D. | 1L1mol/L 的 NaClO 溶液中含有 ClO-的数目为 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com