
| A. | 称取5.1 g Na2CO3,加入500 mL水 | |
| B. | 称取13.7 g Na2CO3•10H2O,配成500 mL溶液 | |
| C. | 称取5.3 Na2CO3,加入500 mL水 | |
| D. | 称取14.3 g Na2CO3•10H2O,配成500 mL溶液 |
分析 选取500mL容量瓶,溶液体积为0.5L,结合m=cVM计算.
解答 解:A.加入500 mL水,溶液体积大于0.5L,故A不选;
B.Na2CO3•10H2O的质量为0.5L×0.1mol/L×286g/mol=14.3g,故B不选;
C.Na2CO3的质量为0.5L×0.1mol/L×106g/mol=5.3g,加入500 mL水,溶液体积大于0.5L,故C不选;
D.Na2CO3•10H2O的质量为0.5L×0.1mol/L×286g/mol=14.3g,配成500 mL溶液,溶液浓度为0.1mol/L,故D选;
故选D.
点评 本题考查配制一定浓度的溶液,为高频考点,把握溶液体积与溶剂体积、质量的计算为解答的关键,侧重分析与应用能力的考查,注意溶质及摩尔质量,题目难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:实验题
 能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系.
能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系.| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能 | 436 | 243 | 431 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含大量Fe3+的溶液中:Na+、Cl-、SCN- | |
| B. | 在含大量Al3+的溶液中:Na+、HCO3-、Cl- | |
| C. | $\frac{\\;c(H+)}{c(OH-)}$=10-12溶液中:K+、AlO2-、CO32- | |
| D. | pH=0的溶液中:K+、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +nCH2═
+nCH2═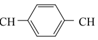 ═CH2$\stackrel{催化剂}{→}$
═CH2$\stackrel{催化剂}{→}$ +(2n-1)HI
+(2n-1)HI| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. |  和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 通过质谱法测定PPV的平均相对分子质量,可得其聚合度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与硫化合时可以发生爆炸 | |
| B. | 等质量的两块钠与足厨氧气分别在加热条件下和常温条件下充分反应失去电子的数目一样多 | |
| C. | 钠着火燃烧时可用泡沫灭火器扑灭 | |
| D. | 工业上可用钠冶炼金属钛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com