
| m |
| M |
| m |
| M |
| 3.12g |
| 78g/mol |
| n |
| v |
| 0.04mol |
| 0.02L |
| n |
| v |
| 0.12mol |
| 0.04L |


 �п������п��Ծ����ϵ�д�
�п������п��Ծ����ϵ�д� ��������״Ԫ��ϵ�д�
��������״Ԫ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
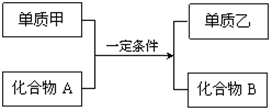 �û���Ӧ��ͨʽ�ɱ�ʾΪ��ͼ�����ʼס��Һͻ�����A��BΪ��ѧ�������ʣ���ش��������⣺
�û���Ӧ��ͨʽ�ɱ�ʾΪ��ͼ�����ʼס��Һͻ�����A��BΪ��ѧ�������ʣ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��184g |
| B��181.8g |
| C��180g |
| D��183.6g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ǿ������Һ�У�K+��Cl-��SO42-��Al3+ |
| B������0.1mol/L Fe3+����Һ�У�I-��SO42-��K+��Mg2+ |
| C��������Ӧ�ܷų�������������Һ�У�Na+��SO42-��CO32-��Cu2+ |
| D������ɫ������Һ�У�Ca2+��Cl-��NO3-��K+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������FeSO4��Һ�е���H2O2��Fe2++H2O2+2H+=Fe3++2H2O |
| B����FeCl2��Һ�еμ���ˮ��Cl2+Fe2+=2Cl-+Fe3+ |
| C������ͨ��ˮ�У�Cl2+H2O=2H++Cl-+ClO- |
| D����̼��������Һ�еμ�����������Һ��OH-+HCO3-=CO32-+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ı�ȼ����Ϊ-890.3kJ?mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+2O2��g��=CO2��g��+2H2O��g����H=-890.3kJ?mol-1 |
| B��500�桢30MPa�£���0.5mol N2��1.5mol H2�����ܱ������г�ַ�Ӧ����NH3��g��������19.3kJ�����Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��?2NH3��g����H=-38.6kJ?mol-1 |
| C��HCl��NaOH��Ӧ���к��ȡ�H=-57.3kJ?mol-1����H2SO4��Ca��OH��2��Ӧ���к��ȡ�H=2����-57.3��kJ?mol-1 |
| D��̼��������Һ�м������Ba��OH��2��Һ��2HCO3-+Ba2++2OH-=BaCO3��+CO32-+2H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com