
| 元素 | A | B | C | D | E |
| 性质或结构信息 | 室温下单质呈气态,原子最外层电子数与D相同 | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 | 单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 | E是一种气态氧化物丙,丙相对于空气的密度为3.0,溶于水可得只含单一溶质的弱酸性溶液,该溶液在放置过程中其酸性会增强 |
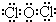 ;并说明丙的水溶液在放置过程中其酸性会增强的原因(用化学方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.
;并说明丙的水溶液在放置过程中其酸性会增强的原因(用化学方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.分析 A、B、C、D为原子序数依次增大的四种短周期元素,
D单质质软,银白色固体,导电性强,在空气中燃烧生成淡黄色固体,则D是Na元素;
A室温下单质呈气态,原子最外层电子数与D相同,则A是H元素;
D3B中阳离子与阴离子的电子层结构相同,B显-3价,且阴阳离子电子层结构相同,所以B是N元素;
A和C可形成两种常见的化合物甲和乙,乙具有弱酸性,C的原子序数大于B小于C,所以C是O元素,乙是双氧水;
E是一种气态氧化物丙,丙相对于空气的密度为3.0,则丙的相对分子质量是87,溶解于水可得只含单一溶质的弱酸性溶液,该溶液在光照条件下放置酸性会增强,则丙是Cl2O,以此解答该题.
解答 解:(1)B原子核外有两个电子层,最外层有5个电子,所以B位于第二周期第VA族,氨气的沸点比氯化氢高,故答案为:第二周期ⅤA族; NH3;
(2)氮化钠和水反应生成氨气和氢氧化钠,所以溶液呈碱性,反应方程式为N3-+4H2O?═?NH3•H2O+3OH-,故答案为:碱性;N3-+4H2O?═?NH3•H2O+3OH-;
(3)丙是Cl2O,其电子式为: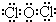 ,次氯酸是弱酸,在光照条件下,次氯酸分解生成盐酸和氧气,发生2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑,所以溶液酸性增强,
,次氯酸是弱酸,在光照条件下,次氯酸分解生成盐酸和氧气,发生2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑,所以溶液酸性增强,
故答案为: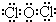 ; 2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑;
; 2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑;
(4)Ⅰ.由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性,则丁是亚硝酸钠,
A.亚硝酸钠能氧化氢碘酸生成碘单质,碘遇淀粉变蓝色,氯化钠和氢碘酸不反应,所以现象不同,可以鉴别,故A正确;
B.氯化钠与硝酸银反应生成白色沉淀,亚硝酸钠和硝酸银溶液反应生成淡黄色沉淀,所以反应现象不相同,所以可以鉴别,故B正确;
C.氯化钠和稀硫酸不反应,亚硝酸钠和稀硫酸反应生成亚硝酸,亚硝酸不稳定生成一氧化氮、二氧化氮,所以现象不同,故C正确;
故答案为:ABC;
Ⅱ.酸性条件下,铜被亚硝酸钠氧化生成,同时亚硝酸钠被还原生成一氧化氮,反应方程式为Cu+2NO2 -+4H +=Cu 2++2NO↑+2H2O,
故答案为:Cu+2NO2-+4H+═Cu2++2NO↑+2H2O;
Ⅲ.①亚硝酸钠具有氧化性,能够将具有强还原性的维生素C氧化,故答案为:还原;
②根据反应,2NaNO2+2H2SO4+2KI=K2SO4+I2+2H2O+Na2SO4+2NO
I2+2Na2S2O3=2NaI+Na2S4O6,
可以得出关系式:2NaNO2~I2~2Na2S2O3,可以得出n(NaNO2)=n(Na2S2O3),
三次滴定消耗的标准液的体积分别为:20.04mL、19.96mL、20.00mL,平均体积为:$\frac{20.04mL+19.96mL+20.00mL}{3}$=20.00mL,
原1L溶液中含有的亚硫酸钠的物质的量是:$\frac{1000ml}{25ml}$×0.05000mol•L-1×0.02L=0.04mol,
1Kg泡菜含有的亚硝酸钠的质量是:69g/mol×0.04mol=2.76g,
0.125Kg泡菜含有的亚硝酸钠质量是:$\frac{0.125Kg}{1Kg}$×2.76g=0.345g,345mg>300mg,会引起中毒,
故答案为:由于345mg>300mg,会引起中毒.
点评 本题考查元素化合物推断、常用化学用语等,存在考查学生对知识的迁移运用,正确推断元素是解本题关键,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 食品保鲜膜、一次性食品袋的主要成分是聚乙烯 | |
| B. | 在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 | |
| C. | 若使用氯气处理水,能达到消毒杀菌和除去悬浮杂质的目的 | |
| D. | 一定浓度的双氧水可用于伤口的消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,有机物 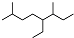 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 环己醇分子中所有的原子可能共平面 | |
| C. | 谷氨酸分子(α-氨基戊二酸)缩合只能形成1种二肽(不考虑立体异构) | |
| D. | 在一定条件下,1.0 mol的  最多能与含3.0 mol NaOH的溶液完全反应 最多能与含3.0 mol NaOH的溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 含l mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热 | |
| B. | 途径②增大O2浓度可提高SO2转化率 | |
| C. | 途径②中SO2和SO3均属于酸性氧化物 | |
| D. | 若△Hl<△H2+△H3,则2H2O2(aq)=2H2O(1)+O2 (g)为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
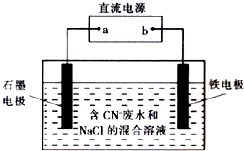 工业上,在强碱性条件下用电解法除去废水中的CN-,装置如右图所示,依次发生的反应有:
工业上,在强碱性条件下用电解法除去废水中的CN-,装置如右图所示,依次发生的反应有:| A. | 除去1 mol CN-,外电路至少需转移5 mol电子 | |
| B. | 通电过程中溶液的pH不断增大 | |
| C. | 为了使电解池连续工作,需要不断补充NaCl | |
| D. | 铁电极上发生的反应为Fe一2e一═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
压强/MPa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com